Un ester odorant

TP B4. Synthèse d’un ester odorant
Objectifs
Réaliser au laboratoire la synthèse d’un ester odorant.
Mettre en œuvre les techniques de chauffage à reflux, décantation, lavage et séchage d'une
phase organique, distillation (avec établissement de la "courbe de distillation", courbe représentative
de la température de la vapeur en tête de colonne en fonction du temps).
Synthèses envisageables
N°
Nom de l’ester
Formule chimique
Acide
Alcool
1
méthanoate de
propyle
H C
O
O
(CH2)2CH3
odeur fruitée
Méthanoïque
(10 mL)
Propan-1-ol
(20 mL)
2
acétate de
butyle
CH3C
O
O
(CH2)3-CH3
odeur de
« bonbons
anglais »
Acétique
(30 mL)
Butan-1-ol
(22 mL)
3
méthanoate
(formiate)
d’éthyle
C
O
O
H
CH2-CH3
odeur de
rhum
Méthanoïque
(10 mL)
Ethanol
(20 mL)
4
butanoate
d'éthyle
CH3CH2CH2C
O
O
CH2CH3
odeur
d’ananas
Butanoïque
(40 mL)
Ethanol
(20 mL)
5
acétate de 3-
méthylbutyle
(isoamyle)
CH3C
O
O
(CH2)2CH(CH3)2
odeur de
banane
Acétique
(30 mL)
3-méthyl
butan-1-ol
(22 mL)
Présentation de la démarche
Les esters ont des arômes souvent agréables et fruités ; ils sont fréquemment employés pour
reproduire les arômes de fruits dans l'industrie alimentaire et donc dans de nombreuses boissons
"fruitées". Leur synthèse est réalisable à l’aide d’un acide et d’un alcool. A l'occasion de la préparation
d’un de ces arômes artificiels quelques techniques spécifiques à la réalisation de synthèses
organiques sont mises en jeu.
Protocole
Matériel et produits
Montage pour chauffage à reflux
Agitateur magnétique
Cristallisoir
Becher de 500 mL
Ampoule à décanter

Montage de distillation avec thermomètre (montant à 150°C)
Deux petits bechers ou erlen (100 mL)
Eprouvette graduée de 50 mL
Pierre ponce
Acide et alcool (suivant la synthèse choisie)
Acide sulfurique concentré
Solution d'hydrogénocarbonate de sodium à 10%
Sulfate de magnésium anhydre
Données physico-chimiques
M (g.mol-1)
densité à
20°C
fus (°C)
sous 1,013
bar
éb (°C)
sous 1,013
bar
Solubilité dans
l'eau
acide acétique
60
1,05
16,6°C
118°C
infinie
3-méthylbutan-1-ol
88
0,81
- 117°C
128,5 °C
faible
Acide méthanoïque
46
1,22
7°C
100°C
infinie
Acide butanoïque
88
0,95
163°C
soluble
Propan-1-ol
60
0,8O
- 126 °C
97 °C
soluble
Ethanol
46
0,79
- 117 °C
78 °C
infinie
Butan-1-ol
74
0,81
- 89 °C
117 °C
faible
acétate de
3-méthylbutyle
130
0,87
- 78,5°C
142°C
faible
méthanoate (formiate)
d’éthyle
74
0,92
- 80 °C
54,5 °C
soluble
butanoate d'éthyle
116
0,88
- 98 °C
121°C
Peu soluble
méthanoate de propyle
88
0,91
- 93°C
82 °C
Peu soluble
acétate de butyle
116
0,88
126°C
insoluble
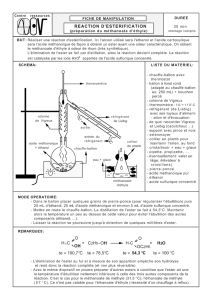
Mode opératoire
Première étape : estérification
Introduire dans un ballon les volumes d'alcool et d'acide indiqués dans le tableau de présentation des
synthèses envisageables, ajouter 1 mL environ d'acide sulfurique concentré
1
et quelques grains de
pierre ponce.
Chauffer à reflux (au minimum 30 min) à l’aide d’un chauffe-ballon.
Laisser refroidir le ballon à l’air puis dans un cristallisoir d'eau glacée.
Deuxième étape : séparation de l'ester, lavage et séchage de la phase organique
Séparation
Après refroidissement, verser le contenu du ballon dans un grand becher contenant environ 100 mL
d'eau ; agiter avec un agitateur de verre, puis laisser reposer. Séparer les deux phases liquides à l'aide
d'une ampoule à décanter et éliminer la phase aqueuse.
Lavage de la phase organique
Ajouter à la phase organique, dans l'ampoule à décanter, environ 30 mL de solution
d'hydrogénocarbonate de sodium : on observe immédiatement un fort dégagement gazeux.
Après un dégazage progressif éliminer à nouveau la phase aqueuse.
Séchage de la phase organique
Récupérer la phase organique et la sécher à l’aide de sulfate de magnésium anhydre filtrer dans un
ballon propre et sec.
Troisième étape : "rectification" de l'ester ou distillation
L'ester obtenu à la fin de l'étape précédente est le "produit brut".
1
Il est également possible d’utiliser environ 0,5 g d’acide p-toluènesulfonique :
SO3HH3C

Réaliser, pour purifier l’ester, une distillation (ne pas oublier d'introduire quelques grains de pierre
ponce).
Au cours de la distillation, on relèvera les températures à intervalles de temps réguliers.
Noter sur la courbe de distillation,
= f(temps), l'apparition des premières gouttes de distillat. Changer
le récepteur lorsque la température en tête de colonne atteint une température proche de la
température d’ébullition de l’ester.
Mesurer le volume de l'ester purifié obtenu.
Exemples de questions
1. Faire un schéma du dispositif de chauffage à reflux en indiquant le nom des pièces de verrerie.
2. Ecrire l’équation de la réaction d'estérification.
3. Pourquoi réaliser l'expérience à chaud ?
4. Rôle de l'acide sulfurique ?
5. A l'aide du tableau des données physico-chimiques, calculer les masses et les quantités de
matière de chacun des réactifs. Dire s'il y a un réactif en excès et si oui, lequel ?
6. Quelle est la masse théorique maximale d’ester que l’on peut obtenir ? Calculer le rendement.
7. Faire un schéma de l'ampoule à décanter et identifier les phases. Justifier.
8. Quelle est la nature du gaz formé lors de l’opération de lavage de la phase organique ? Ecrire
l’équation de la réaction de sa formation à partir des ions hydrogénocarbonate,
-
3
HCO
. Quel est le
rôle de ce traitement lavage ?
9. Pourquoi l’opération de séchage est importante ?
10. Quel est l'aspect du produit brut ? Essayer d'inventorier les impuretés qu'il renferme.
11. Tracer la courbe de distillation :
= f(temps).
12. Calculer le rendement de la synthèse.
Prolongement documentaire
Développer les aspects industriels et les applications à partir d’une recherche documentaire.
1
/
3
100%