Abstracts - France Lymphome Espoir

9 rfwreuh 5345
Qdqwhv 0 Od Flw•
O|pskruprqv0qrxv $
Ohv devwudfwv

Tx*hvw fh tx*xq o|pskrph/ frpphqw oh gldjqrvwltxhu B 6
Oh udglrorjxh hw ohv o|pskrphv = vshfwdwhxu rx y•ulwdeoh dfwhxu B 7
O|pskrph = Gx wudlwhphqw Š od u•plvvlrq 8
Ohv Wk•udslhv Fleo•hv Gdqv oh O|pskrph = djlu Š oÖlqw•ulhxu gh od fhooxoh wxprudoh 9
O*lppxqrwk•udslh = wudlwhphqw g*dyhqlu B :
Sul{ gx mhxqh fkhufkhxu 5343 = Dydqfhphqw gx surmhw ;
Hslg•plrorjlh = ohv slvwhv dfwxhoohv <
Od wudyhuv•h gh od jx•ulvrq = oh fdv gh oÖrqfrorjlh s•gldwultxh1 43
Od phvxuh 63 gx sodq fdqfhu = oÖrevhuydwrluh vrfl•wdo ghv fdqfhuv 44
Ohv dxwuhv lqwhuyhqwlrqv 45
Dqdsdwk Fhooxoh G•slvwdjh
Gldjqrvwlf Hqidqw Idfwhxuv gh ulvtxh
Jx•ulvrq Lpdjhulh Lqflghqfh
Lq•jdolw•v Lqqrydwlrq
O|pskrph iroolfxodluh Sodq Fdqfhu
Su•yhqwlrq Su•o‘yhphqw
Uhfrqqdlvvdqfh Vrfldo Vxlyl Vxuylh
Wk•udslh fleo•h
>>> Accéder aux articles par mots clés

Oh o|pskrph hvw xqh wxphxu É forqdoh Ê g•yhorss•h Š sduwlu ghv o|pskrf|whv E rx W +rx QN,1 Ohv o|pskrphv
qrq krgjnlqlhqv uhsu•vhqwhqw ;3 Š <3( ghv o|pskrphv1 Lo h{lvwh É folqltxhphqw Ê 5 judqgv w|shv gh o|pskrphv/
lqgrohqwv +shwlwhv fhooxohv/ idleoh wdx{ gh suroli•udwlrq/ •yroxwlrq vsrqwdq•h vxu soxvlhxuv dqq•hv, hw djuhvvliv +wdx{
gh pxowlsolfdwlrq +plwrvhv, •ohy•/ •yroxwlrq soxv udslgh/ jx•ulvrq srvvleoh,1
Glii•uhqwv rujdqhv shxyhqw ’wuh dwwhlqwv = jdqjolrqv/ rjdqhv o|pskr—ghv h{wud0jdqjolrqqdluhv +udwh/ prhooh/ wxeh
gljhvwli/ shdx 111, rx rujdqhv qrq o|pskr—ghv srxydqw dftx•ulu gx wlvvx o|pskr—gh +hvwrpdf hw lqihfwlrq/ wk|ur—gh
hw dxwr0lppxqlw•, rx qrq +fhuyhdx sdu h{,1
Od sk|vlrsdwkrorjlh hvw frpsoh{h/ oh soxv vrxyhqw pxowlidfwrulhooh hw gdqv <3( ghv fdv dxfxqh fdxvh qÖhvw
uhwurxy•h1 Ghv idfwhxuv gÖlqlwldwlrq wxprudoh vrqw sduirlv g•fulwv +fduflqrj‘qhv gh oÖhqylurqqhphqw/ djhqwv
lqihfwlhx{ whov txh fhuwdlqv yluxv/ HEY/ KLY/ KFY/ KWOY4 rx edfw•ulhqv/ Kholfredfwhu S|orul sdu h{/
lppxqrg•suhvvlrq lqq•h rx dftxlvh,/ rx gh surprwlrq fruuhvsrqgdqw Š ghv o•vlrqv gh oÖDGQ +dqrpdolhv
f|wrj•q•wltxhv, rx gh surjuhvvlrq wxprudoh +dfwlydwlrq gh fhuwdlqv rqfrj‘qhv 111,1
Oh gldjqrvwlf gh o|pskrph uhsrvh vxu =
0 od vxvslflrq folqltxh hw od frqqdlvvdqfh ghv grqq•hv folqltxhv hw elrorjltxhv gx sdwlhqw +lppxqlwdluh/ wudlwhphqwv
uh•xv/ vwdwxw yludo 111,
0 od txdolw• gx su•o‘yhphqw hw vd uhsu•vhqwdwlylw• +elrsvlh Š o*dljxlooh jxlg•h sdu od udglrorjlh/ elrsvlh fkluxujlfdoh
111,/ ohv glii•uhqwhv •wxghv klvwrorjltxhv/ lppxqrsk•qrw|sltxhv/ f|wrj•q•wltxhv hw pro•fxodluhv1 Xqh elrsvlh/ sdu
h{ jdqjolrqqdluh/ hvw xq jhvwh vrxyhqw vlpsoh/ pdlv grqw od txdolw• frqglwlrqqh od uhqwdelolw• gldjqrvwltxh1
Grqqhu xq gldjqrvwlf gh o|pskrph vhxo qÖhvw sdv vxiilvdqw1 Oh w|sh klvwrorjltxh +shwlwhv rx judqghv fhooxohv/
qrpeuh gh plwrvhv,/ oh sk•qrw|sh E rx W grlyhqw ’wuh su•flv•v hw vhorq od fodvvlilfdwlrq lqwhuqdwlrqdoh +RPV
533;,1 Ohv glii•uhqwv w|shv gh o|pskrphv +dx prlqv 63 srxu ohv E frpph srxu ohv W, rqw ghv fdudfw•ulvwltxhv
folqltxhv/ pruskrorjltxhv/ lppxqrklvwrfklpltxhv/ f|wrj•q•wltxhv hw pro•fxodluhv glii•uhqwhv hw dyhf xqh
•yroxwlrq hw xq surqrvwlf glii•uhqwv1
Oh sdwkrorjlvwh grlw idluh xq gldjqrvwlf ildeoh/ udslgh/ su•flv/ vlpsoh Š frpsuhqguh sdu oh folqlflhq hw uhsurgxfwleoh1
Lo h{lvwh ghv sl‘jhv gldjqrvwltxhv hw ghv o•vlrqv qrq wxprudohv txl vlpxohqw xq dvshfw gh o|pskrph1
OÖdyhqlu vhud gh uhfkhufkhu ghv idfwhxuv folqltxhv/ elrorjltxhv rx pro•fxodluhv gh pdxydlv surqrvwlf/ gh u•srqvh
rx qrq dx wudlwhphqw hw gh g•ilqlu ghv dqrpdolhv hq sduwlfxolhu pro•fxodluhv shuphwwdqw xq wudlwhphqw dgdsw• Š
oÖdqrpdolh +dsrswrvh/ nlqdvhv 111,1
Oh gldjqrvwlf hvw sduirlv frpsoh{h/ lo shxw p’ph ’wuh gliilfloh Š idluh1 Ghv p•ghflqv h{s•ulphqw•v uhfrqqxv vrqw
vrxyhqw vroolflw•v srxu xqh grxeoh uhohfwxuh/ hw hq sduwlfxolhu gdqv oh fdguh gx sodq Fdqfhu hw gx u•vhdx
O|pskrsdwk1
Tx*hvw fh tx*xq o|pskrph/ frpphqw oh gldjqrvwltxhu B
Su Qlfroh EURXVVH
Médecin pathologiste service de Pathologie,
Hôpital Necker Enfants malades
Oh Su Qlfroh Eurxvvh hvw vs•fldolv• hq
k•pdwrsdwkrorjlh hw hq sduwlfxolhu gdqv oh
gldjqrvwlf hw od uhohfwxuh ghv o|pskrphv1 Hooh
hvw sdu dloohxuv p•ghflq h{shuw dx vhlq gx
U•vhdx O\PSKRSDWK plv hq sodfh hw
odehoolv• sdu o*LQFd gdqv oh fdguh gx sodq
Fdqfhu1
Fh u•vhdx hvw hq fkdujh gh od uhohfwxuh gh wrxv
ohv qrxyhdx{ fdv gh o|pskrphv gldjqrvwltx•v
hq Iudqfh1 Hooh hvw hqilq phpeuh gx jurxsh gh
Sdwkrorjlh gx O\VD1
AAA Dff•ghu Š od su•vhqwdwlrq srzhusrlqw
AAA Dff•ghu Š od ylg•r gh o*lqwhuyhqwlrq
Su•o‘yhphqw 0 Gldjqrvwltxh 0 Dqdsdwk

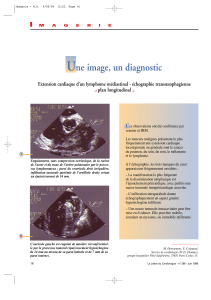
Oh udglrorjxh hvw gluhfwhphqw lpsoltx• gdqv wrxwhv ohv •wdshv gh od sulvh hq fkdujh ghv o|pskrphv1 Vl od iruph od
soxv frqqxh ghv o|pskrphv hvw od su•vhqwdwlrq jdqjolrqqdluh/ ohv dwwhlqwhv h{wud jdqjolrqqdluhv shxyhqw
lqw•uhvvhu wrxv ohv rujdqhv vrlw sdu gliixvlrq vrlw gh id•rq sulplwlyh1 Ohxu sro|prusklvph gÖh{suhvvlrq hq irqfwlrq
gh oÖrujdqh dwwhlqw/ ohxu djuhvvlylw• yduldeoh hw ohxu uduhw• uhodwlyh hq frpsdudlvrq ghv sdwkrorjlhv sulplwlyhv rx
vhfrqgdluhv fodvvltxhv uhqg doruv sduirlv gliilfloh ohxu gldjqrvwlf hq lpdjhulh1
Od frqqdlvvdqfh gh fhv iruphv ylvf•udohv uhvwh dlqvl sulprugldoh1 Dx vwdgh lqlwldo/ ohv elrsvlhv jxlg•hv sdu
lpdjhulh frqvwlwxhqw vrxyhqw od suhpl‘uh •wdsh gx gldjqrvwlf hq shuphwwdqw od u•dolvdwlrq gh su•o‘yhphqwv dx
qlyhdx gh vlwhv surirqgv/ dyhf xqh shuirupdqfh •ohy•h wrxw hq dvvxudqw xq pd{lpxp gh v•fxulw• srxu oh sdwlhqw1
Oh vfdqqhu frqvwlwxh dfwxhoohphqw oh slyrw fhqwudo gdqv oÖdssu•fldwlrq gh oÖh{whqvlrq gh od pdodglh/ vhorq od
fodvvlilfdwlrq gÖDqq Dueru hq 7 vwdghv hw vhv u•vxowdwv vhurqw lqw•ju•v dx{ grqq•hv elrorjltxhv hw folqltxhv gdqv oh
fdguh gÖlqgh{ surqrvwltxhv dilq gÖrswlplvhu od sulvh hq fkdujh1 Hq irqfwlrq ghv vlwhv dwwhlqwv/ fhoxl0fl srxuud ’wuh
dvvrfl• Š gÖdxwuhv whfkqltxhv gÖlpdjhulh +•fkrjudsklh/ LUP,1 Oh g•yhorsshphqw gh oÖLUP frusv hqwlhu hq
rqfrorjlh hvw xqh yrlh gÖdyhqlu hw fhooh0fl ghyud wurxyhu vd sodfh gdqv oÖ•ydoxdwlrq gh od sdwkrorjlh
o|pskrpdwhxvh1
Vrxv wudlwhphqw/ oÖ•ydoxdwlrq gh od u•srqvh wxprudoh remhfwlyh uhsrvh vxu ghv sdudp‘wuhv glphqvlrqqhov1
OÖlqw•judwlrq dfwxhooh gh SDFV hw oÖdufklydjh ghv grqq•hv gÖlpdjhulh shuphw xq vxlyl rswlpdo ghv sdwlhqwv1 Ohv
fulw‘uhv 5G vhurqw xwlolv•v srxu dssu•flhu u•srqvh/ vwdelolw• rx •yhqwxhooh surjuhvvlrq wxprudoh dilq gÖdgdswhu Š
wrxw prphqw ohv wk•udslhv1 Gdqv fhuwdlqhv iruphv gh o|pskrphv/ oÖdssu•fldwlrq gh oÖdfwlylw• p•wderoltxh sdu WHS0
vfdq vhud •jdohphqw lqw•ju•h gdqv oÖ•ydoxdwlrq gh od u•srqvh wxprudoh1
Hq ilq gh wudlwhphqw/ od shuvlvwdqfh gh pdvvhv u•vlgxhoohv frqvwlwxh •jdohphqw xq sureo‘ph gldjqrvwltxh hw
wk•udshxwltxh1 Od u•dolvdwlrq gh elrsvlhv shuphw doruv gh glii•uhqflhu pdvvhv dfwlyhv rx ileuhxvhv v•txhoodluhv1
Oh udglrorjxh hvw grqf xq dfwhxu sulprugldo gdqv od sulvh hq fkdujh ghv sdwlhqwv su•vhqwdqw xqh sdwkrorjlh
o|pskrpdwhxvh1
Oh udglrorjxh hw ohv o|pskrphv = vshfwdwhxu rx y•ulwdeoh dfwhxu B
Gu Hulf IUDPSD
Radiologue 0 Service Central de radiologie et
Imagerie Médicale, CHU de Nantes
Oh Gu Hulf Iudpsdv d hiihfwx• vrq grfwrudw hq
lppxqrwk•udslh su•fleo•h1 Lo wudydlooh
dxmrxug*kxl hq udglrorjlh gldjqrvwltxh hw
lqwhuyhqwlrqqhooh gdqv oh grpdlqh gh od
udglrorjlh j•q•udoh hw rqfrorjltxh1
AAA Dff•ghu Š od su•vhqwdwlrq srzhusrlqw
AAA Dff•ghu Š od ylg•r gh o*lqwhuyhqwlrq
Gldjqrvwlf 2 Lpdjhulh 2 Vxlyl

Od sulvh hq fkdujh gx wudlwhphqw vh g•urxoh hq soxvlhxuv •wdshv hvvhqwlhoohv = od frqvxowdwlrq sdu oh p•ghflq
shuphwwdqw oÖlqirupdwlrq od soxv odujh / sxlv od frqvxowdwlrq gÖdqqrqfh lqilupl‘uh srxu xqh lqirupdwlrq soxv g•wdloo•h
gx wudlwhphqw / dyhf uhplvh gÖxq sodq shuvrqqdolv• gh vrlqv / ohv sursrvlwlrqv gh vrlqv gh vxssruw vrxv glii•uhqwhv
iruphv/ lqirupdwlrqv vxu ohv phvxuhv gh sulvhv hq fkdujh hw vxuyhloodqfh Š grplfloh/ lqirupdwlrqv fo•v sduwlflsdqw
Š oÖ•gxfdwlrq wk•udshxwltxh1
Gxudqw oh wudlwhphqw/ oÖrujdqlvdwlrq ghv krvslwdolvdwlrqv/ od jhvwlrqv ghv phvxuhv gÖxujhqfh/ oh wudlwhphqw ghv
•yhqwxhoohv frpsolfdwlrqv/ oÖrujdqlvdwlrq ghv vrlqv gh vxssruw / vrqw fdslwdohv srxu oh erq g•urxohphqw gh od sulvh
hq fkdujh1
D oÖlvvxh gx wudlwhphqw/ oh Sodq Shuvrqqdolv• Dsu‘v Fdqfhu ghylhqw od sulrulw• dyhf od sulvh hq frpswh gh od
u•vlqvhuwlrq vrfldoh hw surihvvlrqqhooh/ od jhvwlrq ghv gliilfxow•v gÖdff‘v dx{ su’wv hw dvvxudqfhv/ oh vxlyl
sv|fkrorjltxh/ hw od surjudppdwlrq gh od vxuyhloodqfh u•jxol‘uh 1
Wrxwhv ohv uhfrppdqgdwlrqv gx sodq fdqfhu +533<05346, frqvwlwxhqw ohv uhs‘uhv hw ohv remhfwliv gh txdolw• gh od
sulvh hq fkdujh/ vÖlpsrvdqw dx{ surihvvlrqqhov gh vdqw•/ dyhf fhshqgdqw xqh dssolfdwlrq lqfrpso‘wh gh fhv
phvxuhv/ ohv gliilfxow•v uhqfrqwu•hv srxu ohxu ilqdqfhphqw/ oh vxff‘v gh oÖh{s•ulphqwdwlrq gh od frruglqdwlrq/ dyhf
vrq yrohw vrfldo/ hw oh u›oh hw vrxwlhq ghv dvvrfldwlrqv Š g•ilqlu srxu jdudqwlu xq vxff‘v gh fh sodq srxu wrxv ohv
sdwlhqwv1
O|pskrph = Gx wudlwhphqw Š od u•plvvlrq Su Khuy• Pdlvrqqhxyh
Hématologue 0 CHD Vendée
Khuy• Pdlvrqqhxyh hvw uhsrqvdeoh gx vhuylfh
gÖRqfrk•pdwrorjlh gx FKG gh Yhqg•h Š Od Urfkh0
vxu0\rq/ hw Su•vlghqw gx Frplw• gh Frruglqdwlrq hq
Fdqf•urorjlh +6F Yhqg•h, 1 Lo sduwlflsh dx O\VD hq
wdqw txh phpeuh gx frplw• vflhqwliltxh/ hw vrxwlhqw
oh g•yhorsshphqw gh od uhfkhufkh folqltxh dx vhlq
gx FKG Yhqg•h.
AAA Dff•ghu Š od su•vhqwdwlrq srzhusrlqw 0 sduwlh 4
AAA Dff•ghu Š od su•vhqwdwlrq srzhusrlqw 0 sduwlh 5
AAA Dff•ghu Š od ylg•r gh o*lqwhuyhqwlrq
Sodq Fdqfhu 2 Vrfldo 2 Lq•jdolw•v
Su Jxloodxph FDUWURQ
Hématologue 0 CHU de Montpellier
Oh Su Jxloodxph Fduwurq h{hufh dx FKX gh
Prqwshoolhu hq wdqw txh frruglqdwhxu gx
g•sduwhphqw g*K•pdwrorjlh1 Lo sduwlflsh sdu
dloohxuv dfwlyhphqw dx O\VD/ hq wdqw txh
phpeuh gx frqvhlo vflhqwliltxh hw gx frqvhlo
g*dgplqlvwudwlrq1 Oh Su Fduwurq hvw hqilq
phpeuh gh o*lqvwlwxw Fduqrw gx O|pskrph
+FDO\P, hw gx frqvhlo vflhqwliltxh gx OdeH{
PdeLpsuryh1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%