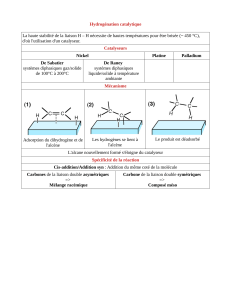
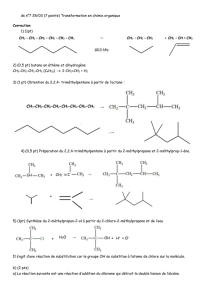
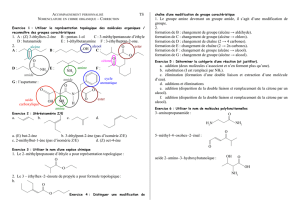
Exercice de révision. Rendement d`une réaction chimique.

Exercice de révision. Rendement d’une réaction chimique.
La déshydratation d’un alcool.
Des élèves de terminale S réalisent en travaux pratiques la déshydratation du 2-méthylbutan-2-ol pour former
du 2-méthylbut-2-ène selon la réaction :
Dans un ballon, contenant 3 grains de pierre ponce, ils introduisent 25,0 mL de 2-méthylbutan-2-ol puis 10 mL
d’acide sulfurique. Le ballon est ensuite placé au sein d’un montage d’hydrodistillation et porté à ébullition
douce (55°C en tête de colonne). Ils transvasent le distillat dans une ampoule à décanter et identifient la phase
aqueuse qu’ils évacuent. Après traitement à l’hydrogénocarbonate de sodium (et évacuation de la nouvelle
phase aqueuse), le produit obtenu est séché au sulfate de magnésium anhydre. Après filtration, ils obtiennent
6,90 g d’alcène.
Que penses-tu du rendement de leur synthèse ? Il s’agit de calculer le rendement de cette synthèse et de dire
si c’est un rendement convenable ou pas.
Données :
Question 1. À quoi sert la pierre ponce ? Et les 10 mL d’acide sulfurique introduit au départ dans le ballon ?
Question 2. Rappeler la définition du rendement d’une réaction et l’expliciter pour la réaction étudiée.
Question 3. Quelle est la masse de produit obtenue ?
Question 4. Quelle est la quantité de réactif introduit ?
Question 5. Identifier le réactif limitant et établir le tableau d’avancement.
Question 6. En déduire la quantité maximale de produit pouvant être fabriquée.
Question 7. Calculer le rendement de la réaction. Réponse : r = 43,1 %
2-méthylbutan-2-ol
2-méthylbut-2-ène
Densité
0,806
0,660
Masse molaire (g.mol-1)
88,0
70,0

Correction. Exercice de révision. Rendement d’une réaction chimique.
Question 1. À quoi sert la pierre ponce ? Et les 10 mL d’acide sulfurique introduit au départ dans le ballon ?
- La pierre ponce sert à réguler l’ébullition.
- L’acide sulfurique n’est pas un deuxième réactif, il sert ici de catalyseur afin d’accélérer la réaction de synthèse.
Question 2. Rappeler la définition du rendement d’une réaction et l’expliciter pour la réaction étudiée.
Le rendement est le quotient de la masse de produit réellement obtenue (mexp = masse expérimentale) par la
masse maximale de produit qui aurait pu être obtenue (mth = masse théorique) soit :
r =
Souvent exprimé en %. Pour la réaction étudiée : r =
Question 3. Quelle est la masse de produit obtenue ?
D’après l’énoncé, la masse d’alcène obtenue est de 6,90 g. Soit m(alcène)exp = 6,90 g.
Question 4. Quelle est la quantité de réactif introduit ?
Les élèves ont introduit un volume V = 25,0 mL d’alcool. Déterminons la quantité de matière contenue dans ce
prélèvement.
n(alcool) =
=
=
A.N. : n(alcool) =
= 0,229 mol
La quantité de réactif introduit est de 0,229 mol.
Question 5. Identifier le réactif limitant et établir le tableau d’avancement.
Il n’y a ici qu’un seul réactif, l’alcool. Il est donc le seul à pouvoir être réactif limitant.
Tableau d’avancement de la réaction étudiée :
La première ligne du tableau contient l’équation de la réaction écrite avec les formules brutes.
Ici, tous les coefficients stœchiométriques valent 1 (il n’y a pas de chiffres devant les formules des espèces).
avancement
C5 H12 O C5 H10 + H2O
État initial
0
n0 (alcool)
0
0
État intermédiaire
(En cours de transformation)
x
n0(alcool) − x
x
x
État final
xf
nf (alcool) =
n0(alccol) − xf
nf (alcène)
xf
Question 6 : En déduire la quantité maximale de produit pouvant être fabriquée.
Déterminons xmax : c’est l’avancement maximal.
Il se détermine en raisonnant ainsi : si, à l’état final, l’un des réactifs est entièrement consommé alors, en regardant le tableau
d’avancement, (ici on regarde la case correspondant au seul réactif présent : l’alcool), la case grise), on annule la quantité de matière
présente dans cette case.
On remplace alors l’indice « f » correspondant à « final » pour l’état final par « max » :
Si l’alcool est entièrement consommé alors : n0(alcool) – xmax = 0
Donc xmax = n0(alcool) = 0,229 mol.
D’après le tableau d’avancement, la quantité maximale fabriquée d’alcène est xf qui devient à l’état final xmax : on a alors fabriqué au
maximum : n max (alcène) = xmax.
La quantité maximale d’alcène pouvant être fabriquée est 0,229 mol.
Question 7. Calculer le rendement de la réaction.
D’après la question précédente, on connaît la quantité de matière maximale pouvant être fabriquée alors on peut
en déduire la masse maximale d’alcène pouvant être fabriquée :
m(alcène)th = n max (alcène) x M(alcène) = 0,229 x 70,0 = 16,0 g.
On a donc r =
=
= 0,431. Il faut exprimer ce rendement en pourcentage : r = 43,1%.
Le rendement de cette réaction est de 43,1%.
On s’attend à fabriquer 16,0 g d’alcène mais on en fabrique 6,9 g seulement, ceci est assez habituel en chimie
organique du fait de toutes les sources de pertes qu’il y a dans ce type de synthèse.
C’est un rendement convenable pour une expérience de travaux pratiques.
1
/
2
100%