Extraction d`un liquide et isolement du liquide brut

CHIMIE ORGANIQUE - LIQUIDES
Année 2013 - 2014
BLANCHARD Mickaël – Technicien de Recherche et de Formation – Lycée Paul Constans - Montluçon
Extraction d’un liquide et isolement du liquide brut
1- Isolement d’un liquide :
Pour retirer un liquide contenu dans un milieu réactionnel on peut :
Hydrodistiller
Le principe consiste à extraire le liquide du milieu par ajout d’eau en créant un
hétéroazéotrope avec ledit liquide (si le produit ne forme pas d’hétéroazéotrope il est
impossible d’hydrodistiller). Le chauffage pousse le composé recherché dans la tête de
distillation puis les vapeurs sont condensées dans le réfrigérant droit (type Liebig).
On considère que l’hydrodistillation est terminée quand plus aucune goutte huileuse et
biphasique ne sort de l’allonge coudée et/ou quand la température au col de cygne (tête de
distillation) atteint ~100°C (température d’ébullition de l’eau). Le produit désiré pouvant être
légèrement soluble dans l’eau on peut prolonger l’hydrodistillation quelques minutes
supplémentaires.
ATTENTION : l’hydrodistillation est une méthode de séparation et non de purification.
Il ne faut pas mettre de colonne Vigreux.
Photo d’un montage d’hydrodistillation
Relarguer
Le principe du relargage est de déverser le milieu réactionnel (généralement
biphasique) sur de l’eau salée et saturée. L’eau salée saturée empêchera la phase
organique désirée de se mélanger avec le milieu aqueux.
Le chlorure de sodium, plus soluble dans l’eau que dans la phase organique,
augmente la force ionique de la phase aqueuse ce qui repousse la phase organique et limite
la solubilité des composés organiques dans la phase aqueuse.
Solution saturée en chlorure de sodium
Milieu réactionnel
Phase organique

CHIMIE ORGANIQUE - LIQUIDES
Année 2013 - 2014
BLANCHARD Mickaël – Technicien de Recherche et de Formation – Lycée Paul Constans - Montluçon
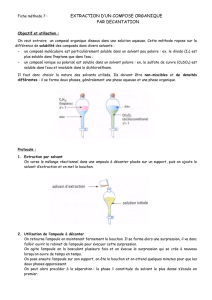
Extraire en ampoule à décanter
Le principe de l’extraction liquide/liquide joue sur la différence de solubilité des
composés présents dans les différentes phases.
Bien que beaucoup de produits organiques soient peu solubles dans l’eau il y en a
toujours une petite quantité qui est solubilisée dans la phase aqueuse. C’est cette petite
quantité qu’on souhaite extraire.
Phase
aqueuse Phase
organique
Boucle
L’ampoule est toujours installée sur une boucle pour la maintenir droite. On prendra
soin de noter chaque bécher, ou tout autre récipient, qui accueillera les différentes phases.
Il faut vérifier que l’ampoule soit étanche au niveau du robinet, voilà pourquoi il faut
toujours prévoir un récipient sous l’ampoule en cas de fuite ; ceci permet d’éviter les pertes
de produit.
On prendra soin de prendre une ampoule à décanter adaptée au volume de la phase
à extraire. Il ne faut jamais qu’une ampoule à décanter soit pleine à plus des 2/3 de sa
contenance. Il faut également vérifier la taille de la boucle qui maintiendra l’ampoule,
certaines ampoules, très petites, peuvent passer à travers la boucle et risquent de se casser.
ATTENTION
Le solvant d’extraction peut avoir une densité inférieure à l’eau (la phase organique
sera donc la phase supérieure) mais certaines fois, comme avec le dichlorométhane
(densité : 1,30), la phase organique sera la phase inférieure. Il faut toujours vérifier les
propriétés physico-chimiques des solvants d’extraction dans le protocole.
En cas de un doute, pour savoir où se trouve la phase organique, il faut faire le test
en introduisant quelques gouttes d’eau, pour voir dans quelle phase ces gouttes vont se
mélanger.
Quand on décante, on pense à enlever le bouchon, sinon la décantation sera très
longue, voir impossible.
Quand on demande d’extraire la phase aqueuse avec un volume « V » de solvant il
est préférable et surtout plus efficace d’extraire en plusieurs portions de solvant.
(Exemple : extraire par 3 portions de 20 mL de solvant plutôt qu’une seule fois 60 mL de
solvant)

CHIMIE ORGANIQUE - LIQUIDES
Année 2013 - 2014
BLANCHARD Mickaël – Technicien de Recherche et de Formation – Lycée Paul Constans - Montluçon
Quand on utilise une ampoule à décanter on met l’ampoule à l’envers en maintenant
le bouchon dans le creux de sa main (ou en maintenant le bouchon avec son index et le
majeur tandis que le reste de la main maintient le corps de l’ampoule) et en dégazant avec le
robinet dès la première renverse de l’ampoule (avant la première secousse).
Les secousses suivantes devront être de plus en plus rapides afin d’augmenter la
surface de contact (surface d’échange) entre les deux phases. Un dégazage entre chaque
série de secousses est nécessaire. Attention : on ne vise jamais la personne à côté de soi,
de plus on fait cette manipulation sous une sorbonne.
En cas d’émulsion à l’interphase dans l’ampoule, on peut détruire cette dernière en
tournant l’ampoule dans ses deux mains ou en tapotant l’interphase avec une baguette de
verre. Certaines fois l’ajout de chlorure de sodium permet également de briser l’émulsion.
Ne pas confondre « extraction » et « lavage» des différentes phases.
On extrait une phase aqueuse
On lave une phase organique
Rôle des lavages de la phase organique :
Solution de
lavage
Rôles possibles
Equations de réactions
éventuelles
Solution
aqueuse de
NaHCO3
Éliminer l’acidité de la phase
HCO3- + H3O+ = 2H2O + CO2
Solution
aqueuse
acide
Éliminer un composé basique
(ex: amine)
R-NH2 + H3O+ = R-NH3+ + H2O
R-NH2 : Généralement insoluble
dans H2O, selon la nature de R.
R-NH3+ soluble dans H2O et donc
éliminé de la phase organique.
Solution
aqueuse
basique
Éliminer un composé acide
(ex: acide carboxylique)
R-COOH + HO- = R-COO- + H2O
R-COOH Généralement peu
soluble dans l'eau selon la nature de
R
R-COO- soluble dans l'eau.
Eau
Éliminer les espèces solubles
dans l'eau : ions, solvants type
MeOH,…
Retour pH neutre
Eau salée
Même rôle qu'un lavage à l'eau
mais évite de solubiliser la phase
organique moins soluble dans l'eau
salée que dans l'eau.

CHIMIE ORGANIQUE - LIQUIDES
Année 2013 - 2014
BLANCHARD Mickaël – Technicien de Recherche et de Formation – Lycée Paul Constans - Montluçon
Quand le but des lavages est d’éliminer un acide ou une base, on vérifie l’efficacité de
ces derniers. On prend le pH à l’aide d’un petit morceau de papier pH qu’on dépose à la
sortie de l’ampoule à décanter. Quand on élimine un oxydant on utilise du papier iodo-
amidonné.
Pour les lavages avec une solution d’hydrogénocarbonate de sodium, on s’aperçoit de
l’efficacité de ces derniers quand il n’y a plus de dégagement gazeux de CO2. (Un test au
papier pH est tout de même nécessaire).
Séchage du liquide :
Pour obtenir un liquide le plus pur possible lors de la distillation fractionnée, surtout si
ce dernier forme un hétéroazéotrope avec l’eau, il faut éliminer l’humidité présente dans la
phase organique. A cause de l’humidité, on peut fabriquer un intermédiaire de synthèse
« parasite » où lors de l’étape suivante il faudra travailler en milieu anhydre avec de la
verrerie sèche. Si le produit est humide, la réaction peut ne pas se faire ou, au contraire,
avoir lieu violemment.
Procédure de séchage :
- On installe la phase organique dans un erlenmeyer rodé sec.
- On met 2-3 spatules de desséchant.
- On agite manuellement pour voir si le produit est aggloméré. S’il n’y a pas de solide
qui reste en suspension on continue à rajouter du desséchant jusqu’à ce qu’il y ait une pluie
de particules.
- On introduit un barreau aimanté, on bouche l’erlenmeyer et on le laisse agiter
pendant 10 bonnes minutes après l’avoir fixé (pendant l’agitation on peut vérifier si la
quantité de desséchant est toujours suffisante).
- On filtre le desséchant sur un entonnoir, où l’on aura placé au préalable une petite
boule de coton (on évitera le papier filtre plissé qui retient beaucoup trop de produit = perte).
- Si le filtrat contient le produit et le solvant à éliminer, on peut rincer le coton avec
quelques mL de solvant pour récupérer un maximum de produit.
- Si le filtrat est le seul produit désiré brut, on essorera le coton avec une baguette de
verre, sans faire passer du solvant sur le coton.
1
2
345678
911
0
2
345678
9
11
Desséchant
Phase organique
Barreau aimanté
Particules qui
se détachent
pince
Bouchon
Ajout de desséchant Agitation manuelle pour voir Erlenmeyer fixé, bouché, agité
s’il y a des particules en suspension
Type de desséchant :
Les plus courants sont le sulfate de magnésium anhydre MgSO4 et le sulfate de sodium
anhydre Na2SO4. MgSO4 est plus efficace que Na2SO4, car il capte 7 molécules d’eau alors
que la même quantité de sulfate de sodium ne captera que 2 molécules d’eau.

CHIMIE ORGANIQUE - LIQUIDES
Année 2013 - 2014
BLANCHARD Mickaël – Technicien de Recherche et de Formation – Lycée Paul Constans - Montluçon
Les hydrates formés sont MgSO4,7H2O et Na2SO4,2H2O
Le sulfate de magnésium, malgré son efficacité, est à proscrire si on sèche une amine,
car cette dernière va former un complexe avec l’ion magnésium.
Élimination des solvants de réaction et d’extraction :
Dans certains cas, avant de purifier le liquide par distillation fractionnée, il faut se
débarrasser du solvant qui a permis d’extraire le composé souhaité, ou d’éliminer le solvant
de réaction.
Deux possibilités s’offrent à vous :
- Faire un montage de distillation simple (sans colonne comme pour l’hydrodistillation) le
solvant sera éliminé après que la température d’ébullition soit dépassée et/ou quand le débit
devient nul.
- Éliminer le solvant par évaporation sous pression réduite.
Evaporateur rotatif (appelé également « rotavap »)
- Le mélange est introduit dans le ballon « bouilleur » (ballon qui sera placé plus tard dans le
bain-marie). Après avoir mis la rotation de ce ballon en marche, on installe le vide, par le
biais d’une trompe à eau ou d’un vide centralisé, ce qui va abaisser la pression et donc la
température d’ébullition du solvant. Le bouilleur est enfin mis dans le bain-marie. Le solvant
va se condenser dans le réfrigérant à serpentin et sera recueilli dans un ballon « récepteur ».
- Cette méthode est plus rapide qu’une distillation simple. De plus, quand certains produits
sont sensibles à la chaleur, l’évaporation sous pression réduite est plus adaptée qu’un
chauffe-ballon qui risquerait de détériorer le produit sensible aux fortes températures.
- On utilise également un évaporateur rotatif pour éliminer un solvant afin de récupérer un
solide brut dans le ballon « bouilleur ».
 6
6
1
/
6
100%