Chapitre C2 : Extraire et identifier des espèces chimiques

Chapitre C2 : Extraire et identifier des espèces chimiques
Extraire consiste à isoler une espèce chimique du milieu dans laquelle elle se trouve.
Les différents procédés sont : l’enfleurage (pétales de fleurs qu’on laisse tremper dans de la graisse), l’expression
(ou pressage), la macération (la plante reste dans un solvant de quelques heures à quelques semaines), l’infusion (de
l’eau bouillante est versée sur la plante hachée), la décoction (on fait cuire la plante dans de l’eau bouillante), la
distillation, l’extraction par solvant et l’hydrodistillation.
Le technique d’extraction utilisée pour extraire une espèce chimique dépend :
- des propriétés physico-chimiques de l’espèce chimique
- du milieu duquel il faut extraire l’espèce chimique
I) Polarité des molécules
Une liaison entre deux atomes est polarisée si les deux atomes sont différents.
Une molécule est polaire si les barycentres de charges positives et négatives ne
sont pas confondus. Ainsi la molécule d'eau est polaire alors que la molécule de
tétrachlorométhane ne l'est pas.
Deux molécules polaires (alcool ROH, acide carboxylique RCOOH) ou deux molécules
non polaires (alcane, alcène) sont miscibles.
Une molécule non polaire et une molécule polaire ne sont pas miscibles.
Remarque : Pour un même composé, il peut y avoir compétition entre le caractère apolaire de la chaîne carbonée et
le caractère polaire ou ionique d’un groupe. Ainsi, les acides carboxyliques à longue chaîne carbonée sont insolubles
dans l’eau alors que ceux dont la chaîne carbonée est courte sont solubles dans l’eau.
II) Techniques d’extraction
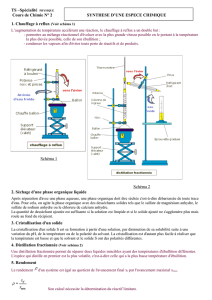
II.1. Distillation
La distillation permet de séparer deux liquides miscibles dont les températures d’ébullition sont différentes.
1 : ……………………………….
2 : ………………………………
3 : ……………………………….
4 : ……………………………….
5 : ……………………………….
6 : ……………………………….
7 : ……………………………….
8 : ………………………………

II.2. Hydrodistillation
L’hydrodistillation permet d’extraire de leur milieu des composés organiques volatils, très peu solubles dans
l’eau.
Elle consiste à porter à ébullition un mélange, puis à condenser les vapeurs qui se dégagent afin de récupérer les
arômes, composés organiques volatils.
Le composé organique se vaporise, lors de l’ébullition, en même temps que l'eau, à une température inférieure à sa
température d’ébullition, ce qui permet de ne pas détériorer ses qualités.
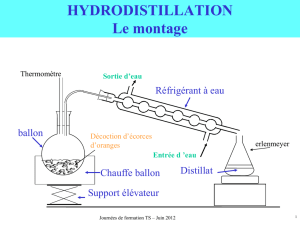
Schéma du montage
Protocole pour réaliser l’extraction du limonène dans l’écorce d’orange (ou de citron) par hydrodistillation.
Dans un ballon monocol, on introduit l’écorce broyée d’une orange, on ajoute 100mL d’eau et quelques grains de
pierre ponce.
On place le ballon monocol sur un chauffe-ballon posé sur un support élévateur.
On adapte sur le ballon l’ensemble « tube coudé – réfrigérant à eau ».
Le ballon et le réfrigérant à eau sont maintenus à l’aide d’une pince.
On place à la sortie du réfrigérant un récipient afin de récupérer le distillat.
On adapte le tuyau d’arrivée d’eau du réfrigérant à un robinet d’eau froide et on place le tuyau de sortie d’eau
dans l’évier. On ouvre doucement le robinet jusqu’à obtenir un débit suffisant. On vérifie le bon équilibre du
montage.
On met le chauffage en marche et on agit sur le thermostat afin d’assurer un ébullition douce.
Lorsque l’hydrodistillation est terminée (60 à 70mL de distillat recueilli), on éteint le chauffage, on baisse le
chauffe-ballon et on ferme l’arrivée d’eau.
1 : ……………………………….
2 : ………………………………
3 : ……………………………….
4 : ……………………………….
5 : ……………………………….
6 : ……………………………….
7 : ……………………………….
8 : ………………………………
9 : ……………………………….
10 : ……………………………….
11 : ……………………………….

Questions :
a) Quel est le rôle de la pierre ponce ? …………………………………………………………………………………………………………………………
b) Quel est le rôle du réfrigérant ? …………………………………………………………………………………………………………………………
c) Quel est le rôle de la vapeur d’eau produite lors du chauffage ? ………………………………………………………………………
d) Le distillat recueilli présente 2 phases : pourquoi ? ………………………………………………………………………
e) Où se trouve la phase aqueuse ? justifier : ………………………………………………………………………………………………………………………
Données :
II.3. Extraction liquide –liquide
L’extraction liquide-liquide consiste à faire passer, par solubilisation, un composé d’un solvant S1 dans un autre
solvant S2 appelé solvant extracteur.
En règle générale, les espèces chimiques organiques se retrouvent, après extraction, dans la phase organique, et
les espèces chimiques ioniques ou très polaires dans la phase aqueuse.
Les espèces à la fois organiques et polaires se partagent entre les deux phases.
L’espèce chimique à isoler est mélangée, ou partiellement dissoute, dans un solvant S1.
On l’extrait avec un solvant extracteur S2 en plusieurs étapes.
1ère étape : le relargage.
Il reste des molécules de composé organique dans la phase aqueuse. On veut les récupérer dans la phase organique.
Comme ces molécules sont encore moins solubles dans une solution aqueuse ionique que dans l'eau pure, on ajoute
une solution ionique au distillat. En agitant, pratiquement toutes les molécules organique qui étaient encore
présentes dans la phase aqueuse passent alors dans la phase organique.
L'opération se fait dans une ampoule à décanter.
Remarque : La solution ionique utilisée est souvent une solution de chlorure de sodium saturée.
Expérience : Verser le distillat précédemment obtenu dans une ampoule à décanter.
Rincer l’erlenmeyer qui le contenait avec 50 mL environ d'une solution saturée de chlorure de sodium.
Ajouter cette solution au distillat.
Agiter avec précaution en prenant soin de dégazer.
En utilisant le tableau précédent, justifier l’utilisation de l’eau salée pour extraire le limonène :
…………………………………………………………………………………………………………………………
2ème étape : décantation.
On laisse reposer. Peu à peu les 2 phases se séparent.
Faire ci-contre un schéma de l’ampoule à décanter en précisant
où se trouve les deux phases :
Lorsque les 2 phases sont bien distinctes, on les sépare en recueillant
la solution ionique dans un premier bécher (elle sera ensuite jetée) et
l'autre phase dans un deuxième petit bécher.
3ème étape : le séchage.
Afin d’éliminer les dernières gouttes d’eau qui ont pu être entraînées
avec la phase organique, on ajoute quelques cristaux de sulfate de
magnésium anhydre.
Le limonène ainsi obtenu sera conservé pour un prochain TP.
Eau
Limonène
Eau salée
TEbullition
100°C
177°C
> 100°C
Densité
1
0,84
1,1
Solubilité dans l’eau
Faible
Solubilité dans l’eau
salée
Très faible
1
/
3
100%