La pile électrique

La pile électrique chimique
Il existe plusieurs types de piles électriques, et la majorité d’entre elles sont des piles électriques
chimiques.
Une pile chimique est composée de
a) 1 électrode +, endroit où se produit une réaction chimique avec perte d’électrons.
b) 1 électrode -, endroit où se produit une réaction chimique avec réception d’électrons.
c) Un milieu de transport entre les 2 électrodes, très souvent un électrolyte (solutions où il y a
des ions libres).
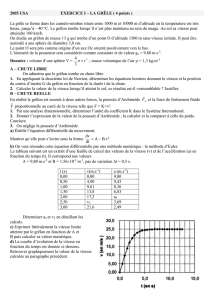
L’exemple suivant est l’exemple classique de la pile de Daniell, qui utilise une électrode de cuivre et
une électrode de zinc.
Cu
Zn
p
o
n
t
d
e
s
e
l
(
e
x
:
K
C
l
d
a
n
s
u
n
g
e
l
)
:Ion SO
4--
solution de ZnSO
4
(aq) solution de CuSO
4
(aq)
++
++
++ ++
++
++
++
++
++
++
++
++
++
:Ion Zn
++
++
++
++
++
++
++
++
++
++
++
++
++ :Ion Cu
++
L’équilibre chimique :
Dans la nature, les réactions chimiques se produisent jusqu’à ce qu’un équilibre chimique soit atteint.
Qu’entend-on par là ?
Considérons seulement le côté droit de la pile :
S’il n’y a pas assez d’ions Cu
++
dans la solution, des atomes de Cu peuvent se détacher de l’électrode
et devenir des ions Cu
++
. Des électrons demeureront sur l’électrode. La réaction ira alors dans le sens :
Cu → Cu
++
+ 2e
-
S’il y a trop d’ions Cu
++
dans la solution, des ions Cu
++
se lient avec les électrons libres de l’électrode
de cuivre, pour former des atomes de cuivre et la réaction ira dans le sens :
Cu
++
+ 2e
-
→ Cu
Bien entendu, une situation similaire existe du côté de l’électrode de Zn.

La réaction chimique commence :
Pour les besoins de la compréhension, imaginons par exemple, qu’au départ, il y a TROP d’ions Cu
++
dans la solution de droite. Alors les ions Cu
++
se lient avec les électrons libres de l’électrode de cuivre
pour former de nouveaux atomes de cuivre, et la réaction suivante commence :
Cu
++
+ 2e
-
→ Cu
L’électrode de cuivre a perdu des électrons et elle commence à devenir POSITIVE.
Par contre la solution de droite est devenue négative (puisque elle a perdu des ions Cu
++
). La solution
de droite attire les ions + du pont de sel. Le pont de sel devient temporairement négatif… des ions
négatifs du pont de sel sont alors repoussés vers la solution de gauche, qui devient négative à son tour.
Repoussés par cette solution négative, des électrons sont arrachés sur quelques atomes de Zn de
l’électrode et des ions Zn
++
entrent dans la solution :
Zn → Zn
++
+ 2e
-
Et voilà l’électrode de zinc qui se couvre d’électrons et qui commence à devenir NÉGATIVE !
Voici donc le mouvement d’ions qui est amorcé :
Cu
Zn
:Ion SO4--
++
++
++ ++
++
++
++
++
++
++
++
++
:Ion Zn++
++
++
++
++
++
++
++
++
++
++
++
:Ion Cu++
+
+
++
e-
e-
K+
Cl-
Mais cela semble contraire à l’ordre des choses… Les ions + devraient être repoussés par
l’électrode +, pas attirés ! C’est vrai, mais pour l’instant, la réaction chimique gagne encore… la
tendance des ions Cu
++
à recevoir des électrons et celle des atomes de Zn à en perdre l’emporte sur
cette répulsion électrique. Le mouvement s’arrête quand les 2 électrodes se sont chargées
suffisamment pour empêcher les réactions chimiques de se produire (bien entendu il y a également la
possibilité qu’un des 2 réactifs s’épuise).

Cu
Zn
++
++ ++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
+
+
++
+
+
+
+
champ électrique des électrodes
agent extérieur (réactions chimiques)
ÉQUILIBRE
Comme il y a un champ électrique entre les deux électrodes, il y a également une différence de
potentiel que nous pourrions calculer en intégrant le champ électrique entre les 2 électrodes suivant
n’importe quel chemin :
électrode de Cu
électrode de Zn
E ds
Cu Zn
V V V∆ = − = −
∫
i
. Bien entendu, il s’agit de la différence de
potentiel mesurée (par un voltmètre) aux bornes de la pile.
On est en droit maintenant de se poser quelques questions…
a) Le pont de sel est-il nécessaire ?
Il est effectivement nécessaire dans la pile de Daniell. S’il n’était pas là, voici ce qui
se produirait à court terme :
Cu
Zn
++
++
++
Atome de Cu
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
L’électrode de zinc se couvre d’une couche de cuivre ! En fait la réaction qui s’est
produite à cette électrode est directement Cu
++
+ Zn
→ Cu + Zn
++
. Les électrons « aiment »
plus le cuivre que le zinc (le cuivre perd moins facilement ses électrons) et les ions Cu++
s’attachent aux électrons de l’électrode de zinc. Les deux électrodes sont devenues semblables.
Les ions n’ont aucune raison d’aller d’un côté ou de l’autre. Il n’y a plus de pile !

Si l’électrolyte est moins liquide (ex : dans une pile de Cu/Zn avec un citron comme
électrolyte), et que les ions peuvent moins facilement migrer complètement d’une électrode à
l’autre, le pont de sel n’est pas vraiment nécessaire.
Dans une pile « alcaline » courante, l’électrolyte est une pâte, et la migration des ions
d’une électrode à l’autre est plus difficile. Il y a quand même un « séparateur » de polymère
qui empêche les produits des réactions de se mélanger.
b) Si on « branche » la pile à une ampoule par exemple, que se passe-t-il ?
Cette fois les 2 électrodes sont reliées l’une à l’autre par un chemin conducteur. Le fil
électrique conducteur est rempli d’électrons libres (comme un boyau plein d’eau) et ces
électrons sont attirés par la borne + et repoussés par la borne -. Il y a un mouvement
d’électrons à l’extérieur de la pile et un mouvement d’ions dans la pile….bref un mouvement
de charges : un courant électrique. Pendant que les électrons se meuvent, les réactions
chimiques continuent à se produire à l’intérieur de la pile. Si la pile est « idéale », la différence
de potentiel à ses bornes demeurent la même que s’il n’y avait pas de courant.
Cu
Zn
++
++ ++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
++
+
+
++
e
-
e
-
K
+
Cl
-
+
+
+
+
courant électrique I
courant électrique I
Ou symboliquement :

c) Qu’arrive-t-il au juste si « un réactif s’épuise » ?
Le « réactif » est ce qu’on trouve « avant » (à gauche de l’équation chimique). Il y a deux
possibilités :
1. Le Zn s’épuise. Alors il n’y aura plus d’électrode à gauche. La pile est morte.
2. Le Cu
++
s’épuise. Cette fois, c’est moins grave. D’autres réactions chimiques peuvent se
produire. Par exemple, ce sont les ions H
+
qui se trouvent toujours dans une solution
aqueuse (il y en a plus si la solution est acide, bien sûr) qui pourraient prendre le relais des
ions Cu
++
.
Au lieu de la réaction Cu
++
+ 2e
-
→ Cu
on a plutôt 2H
+
+ 2e
-
→ H
2
C’est probablement cette dernière réaction qui se produit près de l’électrode de cuivre dans
une pile « Citron ».
d) Qu’est-ce qui fait qu’une pile peut être rechargeable ?
Pour cela, il faut que les produits des réactions chimiques demeurent collés sur l’électrode.
De cette façon, si on force un courant électrique à aller dans le sens inverse de celui montré
plus haut, les réactions chimiques peuvent s’inverser (les réactifs deviennent les produits et
vice-versa).
Dans la pile de Daniell, les ions Zn
++
se dispersent dans la solution, plutôt que de rester
collés sur l’électrode. La pile n’est pas rechargeable.
Dans une cellule de batterie d’automobile, par exemple, les 2 réactions sont :
PbO
2
(s) + 4 H
+
(aq) + SO
4--
(aq) + 2e
-
→ PbSO
4
(s) +2 H
2
O (l)
Pb (s) + SO
4--
(aq) → PbSO
4
(s) +2e
-
Dans les 2 réactions, le produit est un solide, le PbSO
4
(s), qui adhère aux électrodes. Pour
recharger la batterie, on « force » les électrons à bouger dans le sens inverse, et les réactions
sont inversées :
PbSO
4
(s) +2 H
2
O (l) →PbO
2
(s) + 4 H
+
(aq) + SO
4--
(aq) + 2e
-
PbSO
4
(s) +2e
-
→ Pb (s) + SO
4--
(aq)
Le Pb (s) et le PbO
2
(s) se sont reformés, et la batterie est prête à être réutilisée.
 6
6
1
/
6
100%