1214_PCL12-pile danielle

PCL12-CHIMIE
LA PILE DANIELL
I- PRESENTATION
L’accumulation de bulles d’hydrogène sur l’électrode de cuivre
empêche le passage du courant et on constate que la pile de Volta
devient vite inutilisable si on ne la nettoie pas rapidement.
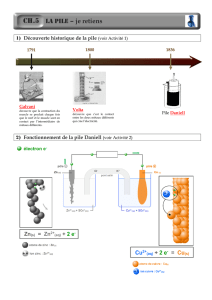
En 1836, John Frédéric Daniell apporte une réponse à ce problème
en proposant une pile constituée de deux compartiments. L’une
contenant une électrode de cuivre, l’autre contenant une électrode
de zinc. Chacune de ces électrodes métalliques est plongée dans
une solution aqueuse contenant son cation métallique. Ces deux
compartiments, appelés aussi « demi-piles », sont reliés entre eux
par un pont salin conduisant le courant.
Matériel : 2 béchers, solution de sulfate de cuivre (CuSO4), solution de sulfate de zinc (ZnSO4), 1
lamelle de Zinc, 1 lamelle de cuivre, 1 papier filtre imbibé d’une solution aqueuse de nitrate de
potassium KNO3, 2 pinces crocodiles, 2 fils électriques et 1 multimètre.
Rappelez les formules des ions présents dans la solution de sulfate de cuivre, de sulfate de zinc et
de nitrate de potassium.
II- MANIPULATION
1) Réalisation de la pile et mesures
a- Complétez le schéma de la pile Daniell (voir fin du TP) avec les termes suivants : électrode de
cuivre, électrode de zinc, Cu2+ + SO42-, Zn2+ + SO42- et pont salin K+ + NO3-. Réalisez cette pile.
b- On souhaite mesurer à l’aide du voltmètre la valeur de la tension UCu/Zn aux bornes de la pile.
Représentez le voltmètre sur le schéma (on rappelle qu’il se branche en dérivation par rapport à
la résistance). Branchez le voltmètre. Mesurez UCu/Zn (faites vos branchements de manière à
obtenir U positif).
c- On branche un conducteur ohmique de résistance R aux bornes de cette pile. Complétez le
schéma en le représentant.
d- Quel est le métal le plus noble ? le moins noble ? En déduire le métal le plus réducteur ? le moins
réducteur ?
e- Se produit-il une réaction chimique d’oxydoréduction au sein de cette pile ? Justifiez votre
réponse.
2) Etude de la réaction chimique d’oxydoréduction
On donne les couples oxydants/réducteurs suivants : Cu2+/Cu, Zn2+/Zn et H2O/H2.
a- Parmi ces six espèces chimiques, indiquez celles qui sont initialement présentes dans la pile
Daniell.
b- Sachant que H20 est un oxydant plus fort que Zn2+ mais moins fort que Cu2+, placez ces trois
couples oxydants-réducteurs sur un axe permettant de comparer les pouvoirs oxydants ainsi que
les pouvoirs réducteurs. Déduisez-en l’oxydant le plus fort ainsi que le réducteur le plus fort.

c- Justifiez le fait qu’il se produise une réaction chimique d’oxydo-réduction.
d- Déduisez des questions précédentes les 2 demi-équations des réactions d’oxydoréduction se
déroulant dans chaque demi-pile ainsi que l’équation bilan de la réaction chimique se produisant
dans la pile.
Dans une pile, l’électrode qui est le siège d’une réduction s’appelle la cathode. C’est le pôle positif de
la pile. L’électrode qui est le siège d’une oxydation s’appelle l’anode. C’est le pôle négatif de la pile.
Dans le cas de la pile Daniell, l’électrode de cuivre est donc …………...……, c’est le pôle …….………
De même, l’électrode de zinc est donc …………………, c’est le pôle ………….
Indiquez sur le schéma la cathode : pôle + et l’anode : pôle -.
3) Circulation des électrons et du courant électrique
a- A partir de la nature des réactions qui se déroulent aux électrodes, indiquez si les électrons
arrivent ou partent de la cathode et de l’anode (on rappelle que les électrons se déplacent dans
les métaux mais pas dans les solutions aqueuses).
Par définition, le sens du courant électrique noté I dans un circuit est opposé à celui des électrons.
De plus, on rappelle que dans les métaux le courant électrique est transporté par les électrons.
b- Par quelles espèces chimiques est transporté le courant électrique I dans les solutions aqueuses
ainsi que dans le pont ionique?
c- Indiquez le sens du courant I sur le schéma.
Le sens de déplacement des cations est le même que celui du courant électrique. Le sens de
déplacement des anions est le même que celui des électrons.
d- Indiquez le sens de déplacement des ions dans les solutions aqueuses et dans le pont ionique.
Dans une pile (Daniell ou volta) le métal le plus noble est le pole ………… et le métal le moins noble
est le pole…………
Schéma de la pile Daniell
1
/
2
100%