Composés Ioniques - Bathurst High School

Révision pour examen - Chimie
Chimie – l’étude de la matière, de ces propriétés et les changements qu’elles subissent.
Matière – tout ce qui possède une masse et qui occupe une espace.
Propriétés physiques – ce qui décrit la matière et que l’on peut observer avec nos sens.
(couleur, senteur, lustre, solubilité, densité, état)
Transformations physiques – changement réversible, la matière demeure inchangé (ex. un
changement d’état)
Propriétés chimiques - décrit comment les éléments et les composés agissent ensemble. Ces
réactions sont des réactions chimiques irréversibles qui créent une nouvelle substance. (Ex : le
fer réagit avec l’oxygène pour faire de l’oxyde de fer (II)).
Le tableau périodique des éléments
Les éléments en ordre de numéro atomique, ce qui donne le nombre de protons de cet
élément.
Les métaux sont situés au côté gauche de l’escalier, les non-métaux au côté droit, sauf
l’hydrogène.
Les rangées se nomment des périodes et les colonnes des groupes.
Les colonnes ou groupes comprennent des éléments avec des propriétés similaires qui sont des
familles d’éléments chimiques.
- Métaux Alcalins
- Métaux Alcalino-Terreux
- Métaux de transition
- Famille de Bore
- Famille de Carbone
- Famille d’azote
- Famille d’oxygène
- Halogènes
- Gaz rares

Modèle de Bohr / ”Lewis dot”
Le modèle de Bohr démontre le noyau de l’atome avec le nombre de protons et de neutrons de
l’atome. Les électrons sont représentés dans les orbites autour du noyau dans les maximums
ci-dessous. (# de protons = numéro atomique, # d’électrons = # de protons, # de neutrons =
masse atomique – nombre de protons)
Orbite #1 – 2 électrons maximum
Orbite #2 – 8 électrons maximum
Orbite #3 – 8 électrons maximum
Orbite #4 – 18 électrons maximum
Un diagramme “Lewis Dot” démontre seulement les électrons de valence (orbite externe) de
l’élément. Les groupes donnent le nombre d’électrons de valence ex : Groupe 1 à 1 électron de
valence, groupe 2 à 2, groupe 13 à 3 etc.)
Dessiner les modèles de Bohr et “Lewis Dot” pour les éléments suivants :
Na
Cl
B
Al

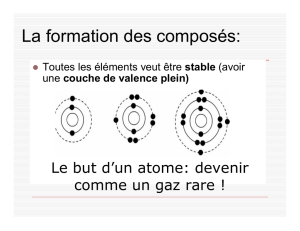
Composés Ioniques
Les éléments forment des composés afin de remplir leur dernière orbite.
Les composés ioniques sont composés d’un métal et d’un non-métal
Les métaux transfèrent leurs électrons aux non-métaux.
Si un élément perd un électron (le métal) il devient un ion positif
Si un élément gagne un électron (le non-métal) il devient un ion négatif
Démontre comment les électrons sont transférés pour faire des composés avec les éléments
suivants:
K et Cl
Mg et N
Sur le tableau périodique, les charges des groupes d’éléments sont comme suit:
Groupe 1 à un électron de valence donc il est plus facile de perdre cet électron et devenir 1+
Groupe 2 = 2+ Groupe 13 = 3+ Groupe 14 = 4+/- Groupe 15 = 3-
Groupe 16 = 2- Groupe 17 = 1-
Groupe 1 et groupe 17 sont les plus réactifs car ils doivent seulement échanger un électron, ce
qui prend moins d’énergie que 3 ou 4. Groupe 18 ne sont pas réactifs du tout car leurs dernière
orbite est déjà remplie.

Les ions se combinent pour faire des composés ioniques
Les composés sont toujours neutres, ce qui veut dire que le nombre de charges positives est
égale au nombre de charges négatives.
Les composés ioniques sont tenus ensemble comme des aimants et sont relativement facile à
séparer. Quand ils sont misent en solution, ils se séparent en ions positifs et négatifs et
peuvent conduire de l’électricité.
1. Combiner les éléments du groupe 1, 2, 13, 14, 15,16 et 17 pour faire des composés
ioniques
- Dans la formule le métal vient en premier et le non-métal second
- Balancer les charges pour faire un composé neutre
- Pour nommer les composés ioniques :
o Change la terminaison du non-métal (-ure, -yde)
o Écrit le métal comme sur le tableau périodique
Écrit le nom et la formule des composés ioniques suivants :
Na et Cl
Ca et P
Al et F
Chlorure de magnésium
Sulfure d’aluminium
Séléniure de calcium

2. Combiner les métaux de transition dans les composés ioniques :
- Si le métal fait partie des métaux de transition (groupes du milieu) et a l’option de
plus qu’une charge, on doit inclure cette charge dans le nom.
- On doit utiliser un chiffre romain pour représenter la charge
o 1 = I
o 2 = II
o 3 = III
o 4 = IV
o 5 = V
o 6 = VI
o 7 = VII
o 8 – VIII
o 9 = IX
o 10 = X
Donne le nom ou la formule des composés suivants :
PbCl4
CoS
PtO2
Oxyde de cuivre (II)
Sulfure d’or (I)
Chlorure d’étain (IV)
 6
6
 7
7
 8
8
 9
9
1
/
9
100%