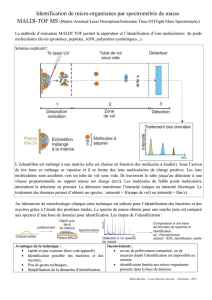
Composés Ioniques Métal + Non

1
Composés Ioniques
Métal + Non-Métal
formes de ions
en solution
NaCl
Na
+
Cl
-

2
Non-Métal + Non-Métal
Composés Moléculaires
Ne forme pas
des ions en
solution
C
6
H
12
O
6
C
6
H
12
O
6

3
Les Diatomiques
hydrogène (H
2
)
azote (N
2
)
oxygène (O
2
)
fluor (F
2
)
chlore (Cl
2
)
brome (Br
2
)
iode (I
2
)
H
H
N
N
O
O
F
F
Cl
Cl
Br
Br
I
I

4
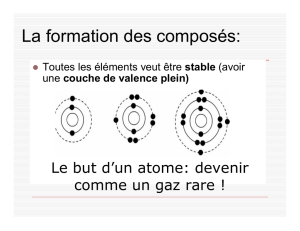
LesComposésIoniquesetmoléculaires
Sic’estionique,mettezun
I.
Sic’estmoléculaire,mettezun
M
.
_____Conduitl’électricité
_____ToujoursSolide
_____Faitavec2nonmétaux
_____Partagelesélectrons
_____Neconduitpasl’électricité
_____Faitavec1métalet1non
métal
_____Solide,liquideougaz
_____Transfèrelesélectrons
_____Peutformerdesions

5
CommentRepresenterdes
Composées
Formule
Modèle
Nom
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%