Science 10F - hrsbstaff.ednet.ns.ca

Science 10F
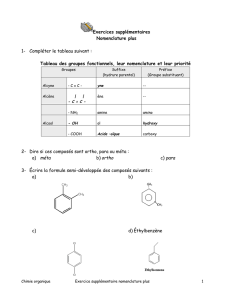
Réactions chimiques
LA FORMATION ET NOMENCLATURE DE COMPOSÉS CHIMIQUES
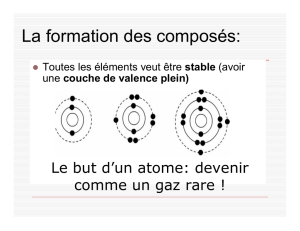
Règle d’octet: Tous les atomes veulent avoir 8 électrons dans leur couche de valence.
Il y a trois façons dont un atome peut acquérir une couche de valence complète:
1. Un atome peut perdre des électrons et devenir plus positif (un cation)
2. Un atome peut recevoir des électrons et devenir plus négatif (un anion)
3. Deux (ou plus) atomes peuvent partager des électrons
Il y a deux types de composés chimiques :
Les composés ioniques
Se composent de deux atomes avec les charges opposées
Généralement, c’est un métal (cation) plus un non-métal (anion)
Les atomes sont liés selon une liaison ionique
Un atome donne un électron et un autre atome l’accepte
Par exemple :

Science 10F
Réactions chimiques
Les composés moléculaires
Se composent de deux atomes qui partagent une paire d’électrons
Généralement, ils sont constitués des atomes de deux ou plusieurs éléments non-
métalliques
Les atomes sont liés selon une liaison covalente
Les atomes partagent les électrons
Par exemple:
La nomenclature des composés binaires
Il y a quatre types importants de composés pour nous de nommer; ionique et
covalent (aussi appelé des composés moléculaires), les acides et les bases.
SOUVENEZ-VOUS : les métaux sont à la gauche de la ligne zigzag du tableau
périodique et les non-métaux sont à la droite de la ligne zigzag.
Les composés ioniques sont des molécules faites d'un élément métal et d'un élément
non-métal.
Les composés covalents sont des molécules faites d'un non-métal et d’un autre
composé non-métal.

Science 10F
Réactions chimiques
La nomenclature des composés
1. Détermine si le composé est un composé métal – non-métal ou non-métal – non-
métal. (**Vérifie votre tableau périodique**).
2. Si la molécule est un composé ionique, voir les règles pour la nomenclature des
composés ioniques.
3. Si la molécule est non-métal – non-métal, voir les règles pour la nomenclature des
composés covalents (moléculaires).
La nomenclature des composés ioniques
1. Écrivez le nom d’anion, mais utilisez "ure" comme une terminaison (ou “ide” pour
oxygène).
2. Écrivez “de” puis le nom du cation.
EXEMPLE :
NaCl : Na est un métal appelé sodium, Cl est un non-métal appelé chlore. Quand
j’écris le nom de NaCl, j’écris chlorure de sodium.
NaCl = Chlorure de sodium
Le changement de la forme écrite à la formule chimique
1. Vérifie le tableau périodique pour le symbole de l’élément.
2. SOUVENEZ-VOUS : les charges de la couche de valence
a. Groupe 1 = +1, Groupe 2 = +2, Groupe 13 = +3, et cetera.
b. Toutes la molécule DOIT avoir une charge totale de ZÉRO.
3. Détermine la charge de valence pour chaque élément dans le nom.
4. Écris les symboles des éléments côte à côte.
5. Écris les souscrits en bas à la droite des symboles pour démontrer le nombre
d’atomes.
6. Utilise autant de chaque atome qu'exigé pour faire la somme des positives et des
négatives pour faire zéro.
EXEMPLE : Oxyde de sodium
O Na
Le sodium a une charge de valence de +1 et l'oxygène a une charge de valence de -2.
Il prendra deux atomes de sodium pour faire une charge de +2.
Ainsi j'écris un souscrit de 2 au-dessous du Na et laisse l'O seul.
La réponse correcte est Na2O
Faire référence à cette page souvent pendant que tu accomplis les questions à l'autre
côté.

Science 10F
Réactions chimiques
La nomenclature des composés ioniques
**Chacune de ces molécules est un composé métal – non-métal.**
Partie A Examine chacune des formules chimiques suivantes et utilise tes règles pour
les nommer.
Exemple : CaCl2 = Chlorure de calcium
Un atome de calcium avec une charge de valence de +2
Deux atomes de chlore avec une charge de valence de -1
Formule chimique
Nom chimique
1. NaI
Iodure de sodium
2. LiBr
3. HCl
4. BeF2
5. K2O
6. Sc2O3
7. Fr3N
8. SrS
9. AlF3
10. Hg3N2
Partie B Change chacune des composés ioniques suivants de son nom chimique à son
formule chimique.
Nom chimique
Formule chimique
1. Bromure de lithium
LiBr
2. Iodure d’hydrogène
3. Sulfure de potassium
4. Séléniure de calcium
5. Nitrure de baryum
6. Phosphure de chromium
7. Chlorure d’holmium
8. Iodure de cadmium
9. Fluorure d’argent
10. Sulfure de gallium

Science 10F
Réactions chimiques
La nomenclature des composés ioniques fait des éléments
polyvalents et des ions polyatomiques
Les éléments polyvalents
De même que vous avez fait avec la dernière feuille, vous aurez besoin de trouver chacun
des éléments dans les composés sur votre tableau périodique. Les groupes de métal de
transition ont des éléments qui ont plus qu'une charge de valence.
EXEMPLE : L’élément 26, Fe (fer), peut avoir une charge de valence de +2 ou +3.
Quand on nomme ces composés, on DOIT démontrer la charge de valence du métal
de transition.
Utilise les chiffres romains pour démontrer la valence de l’élément polyvalent.
I = un III = trois V = cinq VII = sept IX = neuf
II= deux IV = quatre VI = six VIII = huit X = dix
EXEMPLE : Fe2O3
L’oxygène a seulement une charge de valence de -2.
o Il y a 3 atomes d’oxygène. Alors, l’oxygène a une charge de
valence de (-2 x 3) = -6.
Il y a 2 atomes de fer. Fer doit avoir une valence totale de +6.
6 ÷ 2 = 3. Fer doit avoir une charge de valence de +3.
Le composé est appelé Oxyde de fer (III).
La nomenclature des ions polyatomiques
Dans la nature, il y a des collections d'éléments qui joignent, mais ne forment pas de
molécule stable. On appelle ceux-ci les ions polyatomiques. Quand ils adhèrent aux
éléments ou à d'autres ions polyatomiques, ils forment des liaisons ioniques.
Pour nommer un ion polyatomique,
1. Trouvez le nom de l'élément individuel sur le tableau périodique et trouvez l'ion
polyatomique sur le graphique à l'arrière de votre tableau périodique.
2. Écrivez le nom de l'anion (l'ion négatif) en premier et ensuite le nom du cation
(l'ion positif) second. Ne changez pas le nom de l'ion polyatomique quand vous
nommez le composé.
3. SOUVENEZ-VOUS : En appelant des anions individuels, laissez tomber la fin et
ajoutez « -ure ».
EXEMPLE :
KCO3 est composé de K et CO3 : K = potassium; CO3 = carbonate
Le composé est appelé carbonate de potassium.
NH4Br est composé de NH4 et Br : NH4 = ammonium; Br = bromure.
Le composé est appelé bromure d’ammonium.
Pt(MnO4)2 est composé de Pt et MnO4 : Pt = platine (valence de +2, +4);
MnO4 = permanganate
Le composé est appelé permanganate de platine (II).
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%