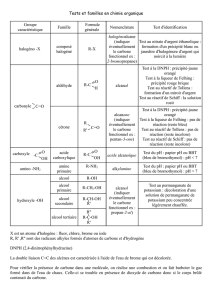
6 Propriété chimiques des dérivées halogénés aliphatiques

Chimie organique mardi 16 mars 2010
1/7
Propriétés chimiques des dérivées halogénées
aliphatiques
A – Réactivité
Les propriété chimiques des halogénoalcanes sont basé sur la
polarisation de la liaison carbone – halogène, les halogènes étant très
électronégatifs, ont tendance à attiré vers eux les électrons de la
liaison sigma, ils vont donc acquérir un supplément d’électrons, d’où
une charge delta-
Evidement le carbone auquel est relié l’halogène sera polarisé delta+,
Ces dérivés peuvent subirent 2 types de réactions :
1er réaction par lesquelles l’atome d’halogène est remplacé ou substitué par un
autre nucléophile, ce nucléophile peut être chargé négativement, dans ce cas là le
produit obtenue est une entité neutre mais il peut être également neutre mais porteur
de doublets libres dans ce cas là le composé obtenue est chargé positivement.
Les réactifs les plus important sont l’ion hydroxyle (OH) l’ion étanolate (C2H5O,
ionisation de l’éthanol), l’ion carboxylate (acide carboxylique qui a perdu un proton)
Parmis les réactifs nucléophiles avec 1 ou plusieurs doublet libres, les amines (R NH2,
H2O ou des alcools)
2e l’atome d’halogène peut être éliminer de la molécule ceci se produit lorsque le
carbone voisin est porteur d’un atome d’hydrogène, l’halogène quittant la molécule sous
forme d’ion halogénure favorise la fragilisation des liaisons voisines et en particulier
d’une liaison carbone – hyrogène porté par le carbone voisin, cette hydrogène s’élimine
sous forme de H+, il y a formation de HX et formation d’une double liaison (composé
éthylénique)
B – Exemples :
Ces réactions de substitution nucléophile permettent à partir d’un dérivé halogéné de
donné un alcool, (substitution du brome)

Chimie organique mardi 16 mars 2010
2/7
Un composé ionique peut substitué l’halogène pour donner un éther
L’ion carboxylate (acide carboxylique – H+), il e substitue de l’atome de chlore et on
obtient un ester
Les nitriles CN- va se substitué à l’atome de Chlore pour donné le nitrile (intéressant car
par hydrolyse ils donnent des acides carboxyliques)
Toutes les réactions d’éliminations conduisent à un alcène.
C – subsitution nucléophile
Si on fait réagire le bromure de méthyle avec OH- on a formation d’un alcool et de Br-
La mesure de la vitesse de réaction montre que celle ci est fonction de la concentration
du réactif (dérivé halogéné) et de la concentration de l’ion OH-
Ces réactions pour lesquelles la vitesse est fonction des 2
composés est donc une substitution nucléophile d’ordre 2
(SN2)
Même réaction avec le bromure de tertiobutyle, on
obtient du tertiobutanole et l’anion Br-, mais dans ce cas
là, la vitesse ne dépend que de la concentration du
réactif c’est à dire du bromure de tertiobutyle, elle ne
dépend que d’un seul composé : il s’agit donc d’une
substitution nucléophile d’ordre 1 (SN1).
Mécanisme et conséquences :
1Er ) SN2
Il s’agit d’un mécanisme en une seule étape au cour de laquelle, le réactif nucléophile va
venir attaqué le carbone porteur de l’atome d’halogène, cette attaque se faisant du côté
opposé à la liaison carbone – halogène, ceci afin d’éloigné au maximum les 2 entités
portant des charges négatives (ou de même signe). A mesure qu’il se forme une liaison
carbone – hydroxyle, la liaison carbone halogène a tendance à se rompre, le résultat final

Chimie organique mardi 16 mars 2010
3/7
étant un dérivé de substitution dans lequel le réactif nucléophile occupe une direction
opposée par rapport à la direction carbone – halogène dans le réactif.
Si l’on prend le cas d’un dérivé halogéné dans lequel le carbone porteur de l’atome
d’halogène est un carbone asymétrique par suite des différences de direction carbone –
halogène et carbone – hydroxyle (dans l’alcool obtenue), on obtient un composé de
configuration opposé, on dit que cette réaction SN2 s’accompagne d’une inversion de
configuration
Remarque : lorsque le réactif nucléophile occupe la
même position dans l’ordre de priorité que l’halogénure
de départ on passe tout simplement d’une configuration
R à S et inversement de S à R
Attention : lorsque l’ordre de priorité est changé, il n’est
pas absolument obligatoire qu’on passe d’une
configuration à l’autre.
Les composés les plus réactifs :
La réactivité du substrat est due à la facilité d’approche du réactif nucléophile, plus le
carbone est encombré stériquement plus l’approche du nucléophile est difficile et plus la
réaction sera difficile, donc ce qui intervient est l’encombrement stérique au niveau du
carbone portant l’atome d’halogène. Donc les halogénures primaires réagiront plus
facilement que les halogénures secondaires qui réagiront plus facilement que les
halogénures tertiaires.
2e) SN1
Les réactions de substitution nucléophiles d’ordres 1 procèdent selon un mécanisme en
2 étapes :
1er étape : formation d’un carbocation, c’est l’étape lente qui impose sa cinétique, cette
réaction ne fait intervenir que le composé halogéné donc il est normal que la vitesse soit
une vitesse d’ordre 1.
2e étape : réaction d’addition du réactif nucléophile sur le carbocation.

Chimie organique mardi 16 mars 2010
4/7
Au point de vue stéréochimique, on
considère toujours un dérivé halogéné
dans lequel le carbone porteur de
l’halogène est un carbone asymétrique , la
première étape conduit à un carbocation
plan, le réactif nucléophile va attaqué le
carbocation soit d’un côté soit de l’autre
du plan 50 – 50 (mélange racémique) et va
conduire à l’obtention de 2 composés de
configuration opposés. (énantiomères)
Réactivité :
La réactivité va dépendre de la facilité avec laquelle l’halogénure va donné un
carbocation, donc on peut dire que les halogénures tertiaires réagirons plus facilement
que les IIair, que les Iairs etc … (stabilité des carbocations)
On pourra dire que lorsqu’il y a réaction de substitution nucléophile, les halogénures
tertiaires réagiront de façons préférentielles selon un mécanisme SN1 alors que les
halogénures primaires par suite de leur faible encombrement stérique réagiront de
façons préférentielles selon un mécanisme SN2
Qui dit formation de carbocation possibilité de
réarrangement avec migration d’atomes ou de
groupements d’atomes afin d’obtenir un
carbocation plus stable.
D – Elimination
Les réactions d’élimination sont marquées par le départ de l’halogène sous forme d’ions
halogénure et de l’hydrogène porté par le carbone voisin sous forme de proton, il existe
des composé dans lesquels la polarisation de la liaison C – H n’est pas suffisante pour
entrainé le départ de l’hydrogène donc ces composés nécessitent la présence d’un anion
pour favorisé le départ de cet hydrogène.
Comme précédemment, les mesures de cinétiques de réactions montrent qu’il existe un
certains nombre de dérivés halogénés pour lesquelles cette cinétique est d’ordre 1 et
fonction uniquement de la concentration du dérivé halogéné, comme précédemment il
existe d’autres dérivé halogénés pour lesquelles la vitesse de réaction est fonction à la
fois de la concentration du dérivé halogéné et de la concentration du réactif nucléophile
intervenant dans le départ de l’hydrogène.
On définira ces réactions avec E1 et E2.

Chimie organique mardi 16 mars 2010
5/7
Quoi qu’il en soit, on obtiendra un alcène le plus stable possible c’est à dire un alcène
pour lequel les carbones de la double liaison sont les plus substitutes c’est à dire qu’ils
possèdent le moins d’hydrogènes.
2 types de réactions :
Cas des éliminations E1 :
Il s’agit d’une cinétique d’ordre 1 avec comme première
étape : formation d’un carbocation qui est l’étape lente.
La 2e étape correspondant au départ de l’hydrogène et à la
formation d’un alcène est une étape rapide.
Comme précédemment on voit que dans l’étape lente n’intervient qu’un seul composé :
le dérivé halogéné donc l’ordre de la vitesse de réaction est un ordre 1.
On obtient à partir du carbocation l’alcène le plus stable :
Réactivité :
On retombe sur la facilité à donner un carbocation, donc réagirons selon un mécanisme
E1 plus facilement les tertiaires que les secondaires que les primaires.
Les halogènes :
Plus l’halogène part facilement plus la réaction sera facile, cela dépend de l’énergie de la
liaison.
Cette énergie est plus faible pour la liaison Carbone – Iode < Carbone – Brome etc …
Nature de la base
Ce qui impose sa cinétique c’est l’étape lente dans laquelle la base n’intervient pas, donc
on prend une base faible qui suffit largement.
Comme il y a carbocation il peut y avoir des réarrangements.
 6
6
 7
7
1
/
7
100%