Syndrome de la queue cheval révélant une métastase du cône

1
Syndrome de la queue cheval révélant
une métastase du cône médullaire
Auteurs:
Hatim Belfquih (1)
Mouhsine abdelilah (2)
Ali Akhaddar (1)
Mandour cherkaoui (1)
Miloudi gazzaz(1)
Brahim el mostarchid (1)
Mohamed Boucetta (1)
(1) Service de Neurochirurgie. Hôpital Militaire d’Instruction Mohammed V. Rabat.
Maroc.
(2) Service de radiologie. Hôpital Militaire d’Instruction Mohammed V. Rabat.
Correspondance:
Hatim belfquih
Adresse : Service de Neurochirurgie. Hôpital Militaire d’Instruction Mohammed V. Rabat.
Maroc.
Email : [email protected]

2
Résumé:
La majorité des lésions médullaires d’origine métastatique sont liées à des compressions
extradurales. Les métastases intra-durales (extra ou intra-médullaire) sont très rares.
Cliniquement, l’installation des déficits neurologiques est rapide d’où la nécessité d’une prise
en charge thérapeutique précoce.
Le cas rapporté est celui d’un patient de 59 ans ayant présenté 20 jours avant son admission
des lombosciatalgies gauches compliquées par un syndrome de la queue de cheval sur une
métastase du cône médullaire dont le profil immunohistochimique évoque une origine
pulmonaire.
Cette observation clinique est inhabituelle caractérisée d’une part par une symptomatologie
radiculaire initiant le tableau clinique et d’autre part par une métastase intra médullaire de
localisation particulière au niveau du cône révélant un adénocarcinome pulmonaire jusque là
occulte. Nous verrons, à l’aide des données de la littérature, les difficultés diagnostiques et
thérapeutiques.
Mots-clés: Métastase intramédullaire, tumeurs du cône médullaire, syndrome de la queue de
cheval, adénocarcinome pulmonaire, IRM médullaire.
Abstract:
The majority of spinal cord due to metastases is related to extradural compression. The intra-
dural metastases (extra or intra-medullary) are very rare.
Clinically, the installation is quick neurological deficits resulting in the need for early

3
therapeutic care.
The reported case is a patient of 59 years who presented 20 days before admission of left
lombosciatalgies complicated by a syndrome of cauda equina metastasis of a medullary cone
immunohistochemical profile suggests a pulmonary origin.
This clinical observation is an unusual one hand characterized by symptoms root initiating the
clinical picture and the other by an intra medullary metastasis particular location in the cone
revealing a hitherto occult lung adenocarcinoma. We see, using data from the literature,
diagnostic and therapeutic difficulties.
Keywords: intramedullary metastasis;conus tumor; Cauda equine syndrome ;lung
adenocarcinoma ; medullary MRI .
Introduction:
Les métastases intramédullaires (MIMs) sont inhabituelles, représentant moins de 8 % de
l’ensemble des métastases du système nerveux central [1, 2,3]. Leurs manifestations cliniques
précèdent exceptionnellement celles de la tumeur primitive [4]. Les localisations
cervicothoraciques sont prédominantes [1].
Nous rapportons le cas d’une métastase d’un adénocarcinome bronchique au niveau du cône
médullaire révélé par une sciatalgie. Seront discutés les particularités diagnostiques et
thérapeutiques de ces tumeurs à la lumière des données de la littérature.
Cas clinique:
Ce patient de 59 ans, tabagique chronique (40 p.a), a présenté suite à un effort physique des
lombosciatalgies gauches mal systématisées compliquées 20 jours plus tard d’une lourdeur

4
des deux membres inférieurs. Devant l’aggravation des troubles de la marche et l’apparition
de troubles sphinctériens à type d’incontinence urinaire, le malade a été adressé en
neurochirurgie. L’examen clinique initial retrouvait un patient en assez bon état général,
eupneïque, avec un syndrome de la queue de cheval complet fait d’une paraplégie flasque,
reflexes osteo-tendineux abolies, anesthésie des deux membres inferieurs avec un niveau
sensitif en sus ombilical, sonde urinaire en place et l’examen cutané avait trouvé une escarre
sacrée très importante. Le reste de l’examen somatique est sans particularité.
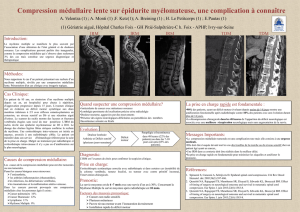
L’imagerie par résonance magnétique (IRM) médullaire réalisée en urgence avait mis en
évidence un processus intraparenchymateux du cône médullaire en regard de D12-L1 iso-
intense en séquences pondérées T1 (Sp T1) (Fig. 1a) rehaussée de façon annulaire après
injection du Gadolinium (Fig. 1b, c et d). En Sp T2 la lésion apparaissait en iso-signal
entourée d’une large plage hyperintense étendue à la moelle cervico-dorsale en rapport avec
l’œdème (Fig. 2 a et b).
Un abord chirurgical a été préconisé ainsi une exérèse subtotale a été effectuée via une
laminectomie D12-L1. L’examen anatomopathologique était en faveur d’une métastase
intramédullaire d’un adénocarcinome d’origine pulmonaire à la lumière du profil
immunohistochimique.
Le dosage des marqueurs tumoraux avait montré une augmentation du taux de (NSE) dans le
sang et le LCR à 68,39 ng/ml (0-16,3) et à 22,08 ng/ml respectivement. Les autres marqueurs
étaient normaux (PSA, AFP, ACE, CA19-9, ..).
Dans le cadre du bilan d’extension, la tomodensitométrie (TDM) thoraco-abdominale avait
visualisée un nodule du champ pulmonaire droit. La TDM cérébrale avait objectivé deux
lésions infracentimétriques l’une hémisphérique cérébelleuse à droite et l’autre pariétale
postérieure parasagittale droite (asymptomatiques). L’état neurologique est demeuré
inchangé.

5
Une chimiothérapie complémentaire a été envisagée mais différée vu l’altération de l’état
général du patient, les infections urinaires à répétition et les soins d’escarres. Nous déplorons
son décès, 3 mois après l’acte chirurgical.
Discussion:
La première description d’une MIM est attribuée à Buchholz en 1897 depuis lors une centaine
de cas ont été répertoriée. Les MIMs représentent 1 à 8% des métastases du système nerveux
central et 1 à 3% de l’ensemble des tumeurs intra médullaires [1, 2,3].
Les MIMs peuvent se développer à partir d’une dissémination hématogène artérielle ou
rétrograde via le système veineux. L’extension directe à travers les nerfs rachidiens ou leurs
gaines a été rapportée comme mécanisme de transportation à partir du site primitif. Weissman
et Grossman ont avancé la participation du canal central a cet essaimage et le rôle du LCR
dans l’extension léptoméningée avec invasion secondaire de la moelle épinière [5, 6],
cependant la dissémination hématogène reste la voie la plus probable des MIMs des
carcinomes pulmonaires [5, 7].
Les MIMs peuvent survenir dans n’importe quel endroit de la moelle épinière mais la
localisation cervicale et thoracique sont les plus fréquentes (40% et 30 % respectivement) [8,
9], le cône médullaire est le site le moins fréquemment atteint comme le cas de notre patient.
La fréquence des origines néoplasiques des MIMs est variable, le cancer bronchique est le
plus fréquemment rencontré (40% à 60% des cas), il s’agit le plus souvent d’un cancer à
petites cellules [10, 11]. D’autres cancers primitifs sont plus rarement responsables,
principalement le cancer du sein (14%) et les lymphomes (7.5%). Les cancers colorectaux, les
cancers rénaux, les cancers de la sphère ORL et de la peau sont rares. Exceptionnellement, le
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%