III-Mécanismes d`alloréactivité

1
Mécanismes de l’alloréactivité, des rejets de greffe
et de la réaction du greffon contre l’hôte.
Marcelo de Carvalho Bittencourt,
, Christophe Baron, Gilles Blancho, Myriam Labalette, Hélène Moins Tesserenc
Ghislaine Sterkers, Pierre Tiberghien
I-Introduction ____________________________________________________________________ 2
II-Alloantigènes. __________________________________________________________________ 2
II-1.Antigènes majeurs d’histocompatibilité __________________________________________ 2
II-2.Antigènes mineurs d’histocompatibilité __________________________________________ 3
II-3.Antigènes des groupes sanguins ________________________________________________ 3
III-Mécanismes d’alloréactivité ______________________________________________________ 3
III-1.Alloréactivité indirecte _______________________________________________________ 3
III-2.Alloréactivité directe ________________________________________________________ 4
IV-Les réactions de rejet en transplantation d’organes. ___________________________________ 4
IV-1.Rejet hyper-aigu ____________________________________________________________ 4
IV-2.Rejet aigu _________________________________________________________________ 5
IV-3.Rejet chronique. ____________________________________________________________ 7
V-La réaction du greffon contre l’hôte (GvH) dans la transplantation de cellules souches
hématopoïétiques allogéniques ______________________________________________________ 7

2
I-Introduction
Les progrès accomplis dans le domaine des traitements immunosuppresseurs ont permis de
développer la transplantation dans la prise en charge des patients atteints d’insuffisance
chronique de différents organes et tissus. L’immunosuppression qui accompagne ces greffes
est nécessaire puisque, au-delà des difficultés techniques chirurgicales, dès les premières
tentatives de transplantation, il est apparu que les greffons devenaient non-fonctionnels dans
un délai relativement court du fait de conflits immunitaires. Ces conflits sont liés à des
différences antigéniques entre les tissus et cellules du donneur et du receveur. Lorsque le
donneur appartient à la même espèce que le receveur, on parle d’alloréactivité, dont l’origine
principale est l’extrême polymorphisme des gènes codant pour les antigènes du complexe
majeur d’histocompatibilité (CMH). Dans les cas très rares où le donneur et le receveur sont
identiques génétiquement (jumeaux monozygotes) il s’agit d’une transplantation syngénique
et aucune réaction immunitaire n’apparaît. On parle enfin de xenoréactivité lorsque le
donneur et le receveur n’appartiennent pas à la même espèce.
Lorsque le receveur est immunodéprimé, comme dans la transplantation de cellules souches
hématopoïétiques, les cellules immunocompétentes contenues dans le greffon sont capables
de reconnaître les alloantigènes de l’hôte et de les rejeter : il s’agit de la maladie du greffon
contre l’hôte ou GVHD (Graft Versus Host Disease). Cette condition particulière est abordée
dans la seconde partie de ce chapitre.
L’alloréactivité reste un obstacle majeur aux transplantations d'organes et de tissus puisque
les rejets immunologiques aboutissent à la perte du greffon de façon pratiquement
inéluctable et relativement rapide sans traitement immunosuppresseur. En effet, chaque
individu possède un taux important de lymphocytes T naïfs capables de reconnaître les
alloantigènes. La fréquence des lymphocytes T naïfs spécifiques d’un antigène donné est
normalement très faible (de l’ordre de 1 pour 100 000, cf. livre L2). Cette fréquence est
beaucoup plus élevée en ce qui concerne les lymphocytes alloréactifs (de l’ordre de 1 à 10
pour 100), ce qui conduit au développement de réponses immunes de forte intensité lorsque
les antigènes d’histocompatibilité de deux individus sont mis en présence.
II-Alloantigènes.
II-1.Antigènes majeurs d’histocompatibilité
Plus de 90% des alloantigènes reconnus sont les produits des différences alléliques entre
les molécules du CMH des individus au sein d’une même espèce. Les différences
génétiques existant entre les nombreux allèles des molécules d’histocompatibilité sont
concentrées au niveau des parties codant la niche à peptide, régions les plus
polymorphiques de ces molécules (cf. livre L2).

3
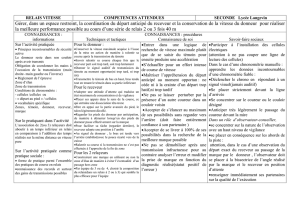
II-2.Antigènes mineurs d’histocompatibilité
Les antigènes mineurs d’histocompatibilité correspondent à des fragments peptidiques issus
de la dégradation de protéines intracellulaires pour lesquelles il existe un polymorphisme
génétique, mais n’appartenant pas au CMH. La présentation d’un antigène mineur est
cependant restreinte par le CMH (Figure 1) et fait intervenir l'alloréactivité indirecte. Les
gènes codant les protéines présentant un polymorphisme allélique se situent sur divers
chromosomes ce qui explique leur transmission autosomique ou gonosomique. Ainsi,
l’antigène H-Y n’est exprimé que par les hommes puisque le gène qui le code est localisé sur
le chromosome Y. Il existe aussi un polymorphisme des cytokines et de leurs récepteurs,
ainsi que des antigènes du système KIR (Killer Immunoglobulin Receptors) présents sur les
cellules NK. Le polymorphisme extensif du génome humain inclut par ailleurs des délétions
de gènes. Le système immunitaire d’un individu porteur d’une délétion homozygote d’un
gène n’a pas acquis de tolérance vis-à-vis du produit de ce gène. En cas de greffe
allogénique il peut reconnaître ce produit comme un alloantigène.
Les antigènes mineurs d’histocompatibilité ont été découverts en raison de phénomènes de
GVH survenus au décours de greffes entre donneur et receveur présentant le même CMH
(greffe HLA-identique). Les antigènes mineurs d'histocompatibilité ne jouent toutefois pas de
rôle déterminant dans la transplantation d'organes.
II-3.Antigènes des groupes sanguins
Les antigènes des groupes sanguins, ABO, sont importants aussi pour la transplantation
car ils sont présents à la surface de plusieurs types cellulaires, dont les cellules
endothéliales. Dans une situation d'incompatibilité ABO donneur-receveur, ils peuvent être la
cible des anticorps naturels, responsables de rejets hyper-aigus.
III-Mécanismes d’alloréactivité
L'alloréactivité peut être classée en deux types en fonction du mode de reconnaissance des
alloantigènes.
III-1.Alloréactivité indirecte
Dans le cas de l’alloréactivité indirecte, les protéines allogéniques du donneur sont
internalisées et apprêtées par les cellules présentatrices d’antigènes du receveur. Les
lymphocytes T CD4 ou CD8 du receveur dont les TCR reconnaissent ces peptides du
donneur présentés respectivement dans les molécules du CMH de classe II ou de classe I
du receveur sont des lymphocytes T dits alloréactifs. Cette reconnaissance indirecte suit
donc le processus physiologique d’amorçage de l’activation lymphocytaire T (cf. livre L2). La
fréquence de lymphocytes alloréactifs potentiellement activés via l’alloréactivité indirecte se
rapproche de celle mesurée pour un antigène étranger donné.

4
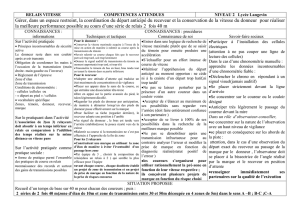
III-2.Alloréactivité directe
A l’opposé, l’alloréactivité directe indique la capacité des lymphocytes T alloréactifs à
reconnaître les molécules du CMH du donneur directement sur les cellules présentatrices
d’antigène contenues dans le greffon. Ces molécules du CMH peuvent contenir des peptides
issus du donneur ou du receveur (Figure 2). L’alloréactivité directe peut paraître surprenante.
Elle tire son origine des particularités de l’ontogénie des lymphocytes T qui subissent
plusieurs étapes de sélection dans le thymus afin de ne conserver que des cellules ayant un
TCR fonctionnel mais non-autoréactives (cf. livre L2). La sélection négative thymique ne
prend pas en compte les molécules du CMH allogéniques qui sont absentes du stroma
thymique d’un individu. Après une greffe, des complexes CMH allogénique/peptides, qui
ressemblent du point du vue tridimensionnel à un complexe CMH du soi/peptide étranger,
peuvent être reconnus par les lymphocytes T du receveur qui n'ont pas été éliminés au cours
de l’ontogénie. Cette reconnaissance donne le premier signal d'activation lymphocytaire.
Un troisième mode de reconnaissance allogénique a été décrit, l'alloréactivité semi-directe,
liée à la propriété des cellules dendritiques de capturer des molécules de surface d'une autre
cellule. Les cellules dendritiques du receveur « capteraient » donc des complexes CMH de
classe I/peptide du donneur, tout en présentant de façon concomitante des peptides issus du
donneur sur leurs propres molécules CMH de classe II.
IV-Les réactions de rejet en transplantation d’organes.
IV-1.Rejet hyper-aigu
Dans les rejets hyper-aigus, des anticorps préformés reconnaissent massivement des cibles
cellulaires présentes dans les petits vaisseaux du greffon. Ceci aboutit à l’activation du
complément, à des lésions thrombo-hémorragiques ou ischémiques et à la mort tissulaire.
Les rejets hyper-aigus surviennent très rapidement, dans les minutes ou les heures qui
suivent la revascularisation du greffon. Des anticorps préformés (consécutifs à des
grossesses, des transfusions non déleucocytées, ou une allogreffe antérieure), dirigés contre
les molécules CMH de classe I du donneur, peuvent être la cause de rejets hyper-aigus.
Comme ces rejets sont extrêmement difficiles à contrôler, il est très important de s'assurer
avant la transplantation que le receveur n'est pas immunisé vis-à-vis des molécules CMH du
donneur. La réalisation d'un crossmatch lymphocytaire permet l'identification d’anticorps anti-
HLA préformés éventuels. Dans ce test on incube des cellules mononucléées du donneur
avec le sérum du receveur en présence de complément et d’un marqueur de viabilité
cellulaire. En cas de présence d'anticorps anti-HLA, la fixation du complément aboutit à la
lyse des cellules du donneur (crossmatch positif). A l'inverse, si les cellules sont viables, il
n’y a pas d’anticorps cytotoxiques anti-donneur chez le receveur (crossmatch négatif).

5
IV-2.Rejet aigu
Les rejets aigus surviennent dans les trois premiers mois suivant la transplantation. Quatre
phases peuvent être identifiées dans la physiopathologie du rejet aigu, reconnaissance,
activation, infiltration et destruction du greffon.
Pendant la phase d'alloreconnaissance ou d’allosensibilisation, l'alloréactivité directe conduit
à l’activation des lymphocytes T alloréactifs par les cellules dendritiques du donneur. Comme
tous les organes, le greffon contient des cellules dendritiques immatures qui agissent comme
cellules sentinelles du système immunitaire. Ces cellules sont sensibles à l’environnement
inflammatoire éventuellement présent chez le donneur, par exemple si celui-ci a subi une
réanimation médicale prolongée. De plus, la transplantation est elle-même génératrice de
signaux de danger capables d'induire une maturation des cellules dendritiques contenues
dans le greffon. La procédure chirurgicale (lésions tissulaires) ainsi que la période d'ischémie
froide, pendant la conservation extra-corporelle du greffon, induisent effectivement un
microenvironnement pro-inflammatoire.
Sur les cellules dendritiques chargées de peptides allogéniques, l'expression du récepteur
de chemokine CCR7 et des molécules d'adhésion augmente. Dans la période précoce post-
transplantation, les cellules dendritiques du donneur vont ainsi migrer vers les zones
lymphocytaires T des ganglions lymphatiques du receveur drainant le greffon. Elles
deviennent matures, augmentent l’expression des molécules CMH et des molécules de
costimulation, et sont alors capables d’activer les lymphocytes T alloréactifs et de débuter
ainsi la réponse immune allogénique.
Cette reconnaissance directe des alloantigènes est responsable d’environ 90% de la
réponse allogénique et des rejets aigus survenant dans les premiers jours ou les premières
semaines post-transplantation.
De façon concomitante, les cellules présentatrices d’antigène du receveur sont attirées vers
le greffon par l’environnement inflammatoire présent dans celui-ci. Ces cellules capturent
des débris tissulaires et migrent également vers les ganglions drainant le greffon.
De plus, des molécules solubles originaires du donneur sont transportées par voie sanguine
vers les ganglions lymphatiques et peuvent être capturées et apprêtées par les cellules
dendritiques du receveur. Ces alloantigènes peuvent être reconnus par les lymphocytes T
alloréactifs par la voie indirecte, ce qui peut induire un rejet aigu avec une cinétique plus
tardive. Cette voie indirecte est responsable de la majorité des rejets aigus survenant à
distance de la transplantation, car il n’y a qu’un petit nombre de cellules dendritiques dans le
greffon.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%