Génétique des microorganismes

Génétique des microorganismes
I- Rappels sur quelques microorganismes et leur mode de reproduction
A- Les champignons
1- La levure Saccharomyces cerevisiae
a- Présentation de la levure et de son cycle de développement
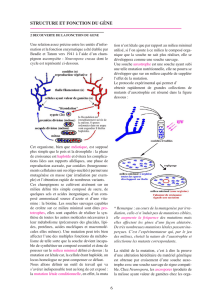
La levure peut faire de la recombinaison homologue stricte. C’est un hémiascomycète : les asques ne
possèdent que 4 spores. Cette levure se divise par bourgeonnement.
En fonction des conditions environnementales la levure a une croissance pseudohyphale. Après
fécondation, la levure est diploïde. Le bourgeonnement se fait aux pôles. La levure se déplace sur le milieu solide de
cette façon pour trouver des nutriments.
Sinon il peut y avoir une multiplication invasive. La levure est alors haploïde. Les bourgeons sont faits sur
une ellipse autour de la cellule mère. On trouve les cellules de types a et α. Lorsque les deux types se rencontre, il y a
formation d’un zygote et les deux cellules fusionnent, puis après quelques multiplications il y a formation d’un asque
contenant 2 a et 2 α.
b- Rappels sur la méiose
En fonction de l’état cellulaire dominant dans le cycle, on trouve des organismes diplobiontique,
haplobiontique et haplodiplobiontique.
Après fécondation les chromosomes sont dupliqués. Il y a la première division de méiose (crossing-over) qui
sépare les bivalents, puis la seconde division qui sépare les chromatides.
2- Champignon filamenteux Neurospora crassa
Il s’agit d’un ascomycète haplobiontique qui possède de septum. On trouve de conidies (♂) et des
protopérithèces (♀). Il y a deux types de champignons : mat A et mat a. après croisement des deux types, un
périthèce se forme et contient des asques à 8 spores ordonnées.
B- Les bactéries
1- La transformation
Elle a été mise en évidence par le transfert d’ADN nu à une bactérie (expérience souche R et S).
Certaines bactéries sont naturellement compétentes, ont une compétence variable ou ne le sont pas. Il faut
de l’ADN bicaténaire d’une certaine taille, et il doit y avoir une similitude de séquence.
a- Transformation naturelle
Chez les Gram +, un complexe protéique fait entrer un brin qui forme un hétéro-duplexe avec le
chromosome. S’il n’est pas formé l’ADN est dégradé.
Chez les Gram -, l’ADN entre dans un transformasome (liposome) s’il possède certaines séquences. Il y a
fusion avec la paroi. Un brin est dégradé, l’autre va former l’hétéro-duplexe ou être dégradé.
b- Transformation artificielle
On fait entrer un plasmide par électroporation ou par traitement au CaCl2 puis chauffage avec du PEG.

2- La conjugaison
Il y a transfert d’ADN d’une bactérie male à une femelle s’il y a un facteur de fertilité pour synthétiser le pili
sexuel. Il peut y avoir un transfert par le pont cytosolique du facteur F, du facteur F et d’un peu d’ADN
chromosomique ou d’une grande portion d’ADN chromosomique. Elle se fait que chez certaines bactéries.
La bactérie est dite male si elle possède le facteur F. S’il s’intègre au génome la bactérie est dite HFr. Il peut
s’exciser avec un fragment d’ADN, on l’appellera alors F’.
Le facteur F est transmis de la façon suivante : il y a une rupture simple brin, un brin est transmis et il y a
réplication dans les deux bactéries, puis fissure du pont.
Pour l’ADN chromosomique, il y a coupure simple brin au niveau du facteur F, transmission d’un brin et
réplication dans les deux bactéries puis recombinaison homologue dans la bactérie réceptrice. Le facteur F est le
dernier transmis, cela se fait rarement.
La sexduction est le transfert de F’ contenant un allèle dominant.
3- La transduction
Il y a transfert d’ADN par intervention d’un phage. Le phage T4 lyse la bactérie, le phage λ peut faire de la
lysogénie (prophage).
Lors d’une transduction spécialisée, l’excision du prophage est décalée et un fragment d’ADN bactérien est
présent d’un côté (f = 10-5).
Lors d’une transduction généralisée, le phage peut s’intégrer à différents endroits, il y a une excision décalée
à de nombreux endroits.
C- Les virus
1- Bactériophage de la série T
Le T7 possède une ARNpol formée d’une seule S.U., et le promoteur T7 n’est lu que par cette polymérase !
Pas de fuite.
2- Bactériophage λ (se circularise avec les extrémités COS)
3- Bactériophage M13 (ADN sb, il est filamenteux)
II- Les mutants
A- Les différents types de mutants
En génétique classique, on étudie un mutant et on déduit le rôle du gène. En génétique inverse on observe le
gène et on détermine sa fonction. On peut définir plusieurs types de mutants.
Mutants auxotrophes
Incapable de croitre sans un nutriment.
Mutants cataboliques
Incapable de dégrader une substance.
Mutants de résistance
Modification d’une perméase, la cible n’est plus reconnue ou mutation By-Pass (inactivation ou sortie de la
substance toxiques). Permet de trouver différents mécanismes de résistance.
Mutants létaux
30% des gènes de Saccharomyces cerevisiae sont essentiels, il ne faut pas les muter.

Mutants conditionnel : thermosensibles ou cryosensibles
Ces mutants sont dit pseudo-sauvages car ils sont sauvages à température permissive mais mutants à
températures non permissive. Les protéines mutantes sont thermolabiles. On ne sait pas pourquoi à températures
basse, les complexes contenants les protéines mutantes se défont.
Mutants de pH
Si une mutation affecte le gène de structure d’une ATPase, il peut y avoir une modification du pH
intracellulaire. Il y a une perturbation totale du métabolisme.
Mutant de morphologie
Ils permettent d‘étudier la polarité cellulaire. Une mutation sur le gène ADE2 donne des colonies rouges et
une auxotrophie vis-à-vis de l’adénine : c’est une mutation pléiotrope (une mutation donne plusieurs modifications
phénotypiques qui ne sont pas expliquée).
La pléiotropie est différente de la polarité d’une mutation. Chez les bactéries il y a des opérons contenant 2 à
8 gènes codants pour des protéines différentes. Si un opéron est muté et qu’il y a apparition d’un codon stop avant
la fin, les protéines suivantes ne sont pas traduites : la mutation est dite polaire (on regarde la molécule d’ADN, que
chez les procaryotes). Il existe des protéines contenant plusieurs sites d’une voix métabolique : c’est un métabolon.
Mutant de développement
Ces mutants sont incapables de réaliser une étape de leur cycle de développement (germination,
sporulation, fécondation).
Mutant de régulation
Il y a la régulation de l’activité enzymatique mais également la régulation de l’expression des gènes.
B- Les mutations
On trouve des mutations ponctuelles (silencieuse, faux-sens, non-sens, frameshift) et des grandes mutations
(génique, chromosomique, génomique).
Il y a différentes qualité de mutation. Premièrement les mutations structurelles :
- Substitution : - Transition (entre purines ou entre pyrimidines) ou transversion (entre purine et pyrimidine).
- Délétion
-Insertion
Mutation par réarrangement qui affecte la localisation d’un gène :
-Nombre de gènes par duplication du gène
-Déplacement d’un locus par translocation ou inversion
Il existe des mutations dans la direction. On trouve les mutations directes (sauvage au mutant) et les
mutations réverses (mutant au sauvage). Ces dernières se décomposent en différentes catégories :
- Réversion vraie
- Suppression : Intragénique (mutation à côté de la première qui donne le même a.a.)
Extragénique : ҉ Informationnel (modification dans un ribosome qui met l’a.a. initial alors qu’il
ne devrait pas, la protéine est sauvage).
҉ Physiologique (deux mutations qui se compensent : moins bonnes fixation de
Cu2+ par une enzyme et augmentation de la perméabilité du Cu2+ donc au final on obtient le phénotype sauvage. Ou
bien un gène est supprimé et il y a une mutation dans un autre gène qu’il affecté).

C- La sélection des mutants
1- Mutagénèse
a- Les radiations
Les rayons X qui forment les dimères T-T.
b- Les produits chimiques
L’éthyl méthane sulfonate entraine des changements de bases (surtout guanine) ; la proflavine s’intercale
entre les bases et entraine une addition de bases lors de la réplication ; le 5-bromouracile remplace la thymine ou
est complémentaire de la guanine, il entraine des changements de bases.
c- L’application du traitement mutagène
Pour les UV, les mutations voulue ne sont pas toujours obtenues et certains microorganismes son très
résistants aux UV (pê peu de thymine à côté). Pour les agents chimiques, les conditions d’utilisation sont
draconiennes.
Le taux de survie est une indication sur l’efficacité de traitement. Pour réobtenir un mutant, il faut faire le
même traitement mutagène. Pour cela on regarde le taux de survie.
La β-mutagénèse insertionnelle repose sur l’intégration d’ADN exogène dans un marqueur de sélection
(gène de résistance ou gène de complémentation d’une mutation auxotrope). Il s’agit généralement d’une
recombinaison non homologue, par exemple un transposons. Il faut en mettre moins que les bactéries pour qu’il y ai
potentiellement une seule mutation par bactérie.
2- Enrichissement
On met en culture le produit de la mutagénèse dans un milieu favorable aux sauvages mais pas pour les
mutants contenant une molécule toxique. Ce composé va entrer majoritairement chez les sauvages car ils poussent
plus vites. La culture est récupérée et mise dans un milieu favorable pour les sauvages et les mutants sans le
composé, mais les sauvages contiennent le composé toxique et donc meurent.
Les composés toxiques peuvent être de la pénicilline (bactéries : contre la synthèse de peptidoglycane) ou de
la nystatine (levure : fixation sur des composés stérols qui modifie la perméabilité membranaire). On peut mettre de
glucose tricié qui va tuer les sauvages si on met la culture au congélateur pendant 3 mois.
3- Crible de sélection
a- Crible de sélection positif
Seuls les mutants sont capables de croître sur le milieu.
b- Crible de sélection négatif
A partir d’un milieu non sélectif on fait une réplique velours sur un milieu sélectif des sauvages. Les mutants
ont été lysés. Pour valider la qualité de la réplique, il faut faire également une réplique sur un milieu non sélectif.
c- Crible de sélection pseudo-positif
Les mutants et sauvages poussent mais sont différenciables.

4- Quelques astuces pour des cribles de sélections
a- Sélection de mutants auxotrophes avec des cribles de sélection positifs
Pour trouver les mutants d’URA3 (enzyme de la voie de synthèse de l’uracile qui transforme un substrat en
produit toxique). Dans le milieu on met beaucoup de ce substrat et peu d’uracile, les sauvages vont synthétiser le
produit toxique alors que les mutants en sont incapables, ils vont donc pousser.
Il existe une sélection des mutants LYS2-.
b- Sélection de mutants létaux avec un crible de sélection positif
Pour sélectionner des mutants donc les colonies présentent un taux de mortalité inférieur des colonies
sauvages. On utilise un colorant vital dégradable par les cellules vivantes. Les colonies colorées sont les mutants.
c- Mutants de pH
L’émission de la GFP est fonction du pH. Si ce gène est transféré dans des levures, qu’il y a mutagénèse, il
suffit de regarder l’intensité de la fluorescence pour sélectionner les mutants.
D- Conservation des souches mutantes
Pour les champignons filamenteux il s’agit généralement du repiquage. Mais il y a une dérive génétique. Il
faut faire des croissement avec la souche sauvage pour sélectionner les mutants.
Pour les spores fongiques il est possible de faire un séchage sur support solide sur bentonite.
Il est possible de congeler à -80°C, ou bien à -196°C (azote liquide) surtout pour les cellules humaines. Il faut
mettre du glycérol comme cryoprotecteur.
Un autre procédé de conservation est la lyophilisation, qui permet de déshydrater les cellules ou l’ADN lors
du passage à température ambiante. Cela prend très peu de place, et cela ne demande pas de température
particulière.
III- Les outils de la génétique
A- Le test de dominance
1- Objectif
Il permet de définir le caractère dominant ou récessif d’un allèle.
2- Réalisation
a- Théorique
On réunit dans un même cytoplasme les allèles sauvage et mutant et on regarde celui qui est exprimé.
b- Pratique
α- Hétérocaryon chez les champignons filamenteux (fusion de deux filaments)
β- Cas de la levure (fusion des cellules a et α pour former un diploïde)
γ- Fusion des protoplastes (on enlève la paroi et on fait fusionner les deux cellules)
 6
6
 7
7
 8
8
1
/
8
100%