Introduction - Nathalie Rion

Montage n° 7
Expériences utilisant des techniques de séparation, de purification et de
caractérisation, courantes en chimie.
Introduction
De nombreuses espèces chimiques présentes dans la nature sont importantes pour l’homme
qui, au cours de son histoire, a cherché à les exploiter. Ces espèces chimiques peuvent être :
Des pigments et des teintures,
Des parfums et des aromes,
Des matières premières des industries pharmaceutique et cosmétique,
Des matières premières des industries agroalimentaires (additifs)
Des matières premières de l’industrie chimique
Le premier travail du chimiste est donc d’extraire l’espèce de son environnement naturel
(extraction, séparation, purification) et de vérifier sa nature (caractérisation). Lors de synthèses
de produits chimiques, le travail de chimiste est le même : souvent, l’espèce synthétisée est
sous forme d’un mélange dont il convient de séparer les composés, ou alors, contient des
impuretés qu’il convient d’enlever (purification). Ensuite, il faut caractériser le produit synthétisé.
Nous allons, au cours de ce montage, mettre en œuvre diverses techniques de séparation,
purification et caractérisation.
I. Séparation des constituants d’un mélange constitué de 3 phases
On utilise une boisson gazeuse qui contient une phase solide (de la pulpe), une phase liquide et
une phase gazeuse (CO2 dissous) : Orangina ®
A défaut, on mettra un peu de sable + limaille de fer dans de la limonade…
I.1 Extraction de la phase gazeuse
Nous avons un mélange qui est composé de 3 phases. Nous souhaitons faire un dosage de
l’acide citrique dans la limonade. Pour cela, il convient de supprimer le gaz contenu dans la
boisson. Le gaz a une meilleure solubilité dans un liquide à froid qu’à chaud. Nous allons utiliser
cette propriété pour extraire le gaz.
On chauffe sous agitation. Tube à dégagement + eau de chaux. On montre qu’on a bien extrait
du CO2.
Conclusion : on a séparé le gaz du liquide en utilisant la propriété de solubilité des gaz . On a
caractérisé ce gaz par un test chimique : Ca2+ + 2HO- + CO2 = CaCO3(s) + H2O.
I.2 Extraction de la phase solide
La technique utilisée est la filtration mécanique. On choisi le type de filtre en adéquation avec
la taille des particules à retenir. (principe : gravité)
Rq : il existe aussi la technique de filtration chimique : résine échangeuse d’ions. On peut
accélérer la filtration en travaillant sous vide (filtre Büchner)
I.3 Séparation des phases solides
En utilisant la différence de propriété magnétique entre le sable et le fer. On utilise un aimant
entouré de film étirable pour retirer facilement la limaille par la suite.
II. Purification des métaux
100 manip T1 n°57.3 p.166 ou TS spé Nathan Sirius
On réalise le même montage mais avec 2 plaques de cuivre que l’on
décape préalablement avec de la toile émery. Placer le tout dans
une solution de sulfate de cuivre à 1 mol.L-1. On peut ajouter un
ampèremètre et un voltmètre.
A l’anode : Cu(s) + 2e- = Cu2+
A la cathode : Cu2+ + 2e- = Cu(s)
Travailler avec un courant de 1 A environ. On peut peser la plaque
avant et après pour montrer qu’il y a variation de masse.
Lancer la manip, puis revenir dessus en fin d’exposé pour faire les

constatations suivantes :
l’anode diminue légèrement de volume et devient plus brillante.
La cathode se recouvre d’une couche de cuivre d’abord noire, puis rouge au fur et à
mesure de sa croissance.
Si on mesure I et que l’on calcule t (durée de l’électrolyse), on peut remonter au Faraday :
F=
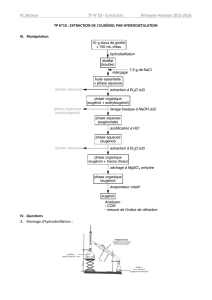
III. Extraction de l'eugénol contenu dans le clou de girofle :
100 manip T2 p. 190 et accomp TS spé pour la chromato
Le clou de girofle contient :
III.1 Hydrodistillation
Le clou de girofle étant solide, il faut le broyer (5g) pour libérer les composés organiques et
ajouter 50 mL d’eau distillée + pierre ponce. On va extraire l’essence naturelle par
hydrodistillation ou entrainement à la vapeur.
On effectue l'hydrodistillation à T = 99°C environ.
(Rq : il ne s'agit ni de la température d'ébullition de l'eau (100°C) ni celle de l'eugénol (153°C)).
On récupère dans un bécher, un mélange très trouble où apparaissent deux phases :
de l’eau et l’huile essentielle de clou de girofle. (à faire en préparation)
Conclusion : l’hydrodistillation a permis d’extraire l’huile essentielle de clou de girofle
(composés aromatiques : on peut sentir l’odeur de clou de girofle)
III.2 Séparation de la phase organique et de la phase aqueuse
On a dans le bécher, une phase organique qui contient l’huile essentielle, et une phase
aqueuse. Le liquide est trouble car il y a émulsion. Il faut maintenant séparer les 2 phases.
Transvaser le distillat dans une ampoule à décanter
Ajouter environ 20 mL de solution saturée de chlorure de sodium, ce qui permet encore
de diminuer la solubilité des composés organiques dans l’eau.
Extraire la phase organique par 2 ou 3 fois 10 mL d’éther (elle se trouve au dessus dans
l’ampoule à décanter (densité éther = 0,7) – c’est la phase aqueuse que l’on remet dans
l’ampoule pour les nouvelles étapes d’extraction) Phase orga 1. En mettre un peu de
côté pour la CCM + Phase aqueuse 1 (on n’en a plus besoin)
Conclusion : on a utilisé la technique de l’extraction par solvant (la phase organique est plus
soluble dans l’éther que dans l’eau) et le principe de la décantation (par gravité)

III.3 Séparation des composés de la phase
organique
La phase organique 1 contient les composés
suivants. Comme on ne veut récupérer que
l’eugénol, il nous faut séparer les 2 composés.
La technique que nous allons utiliser est de
transformer, par réaction chimique, l’eugénol
soluble en phase organique, en eugénolate,
soluble en phase aqueuse. On aura ainsi un mélange liquide formé d’une phase aqueuse
contenant l’eugénolate, et une phase organique contenant l’acétyleugénol. On pourra alors
séparer les phases en utilisant la technique précédente.
Dans une ampoule à décanter (la même que précédemment) laver la phase orga par 2 fois 10
mL d’une solution saturée de bicarbonate de sodium. La phase orga est en haut. C’est elle que
l’on relave.
Ar-OH + HCO3- Ar-O- + H2O + CO2
On récupère Phase orga 2 (qui contient l’acétyleugénol) dans un erlenmeyer et Phase
aqueuse 2 (qui contient l’eugénolate)
Conclusion : on utilise ici une réaction chimique pour rendre insoluble un composé dans la
phase organique. On joue encore sur la différence de solubilité de 2 espèces pour les séparer.
III.4 Régénération de l’eugénol
Par ajout de HCl concentré (12 mol.L-1) jusqu’à pH=1, on transforme l’eugénolate en eugénol.
Dans une nouvelle ampoule à décanter, extraire l’eugénol par 2 fois 5mL d’éther.
On récupère Phase orga 3 (qui contient l’eugénol) dans un erlenmeyer et Phase aqueuse 3
(on n’en a plus besoin)
Ar-O- + HCl Ar-OH + Cl-
III.5 Séchage des phases organiques
On sèche les phases orga 2 et 3 avec du sulfate de sodium ou de magnésium (bien remuer
l’erlen bouché)
Filtrer chaque phase.
Conclusion : on sépare l’eau des composés organique ou on les purifie en faisant réagir l’eau
avec un autre composé chimique en phase solide. Comme on a une phase liquide et une phase
solide, on les sépare par filtration.
III.6 Caractérisation par CCM :
On prend le protocole de l’accomp TS spé
Préparer l’éluant dans la cuve à chromato : 1 mL d’acétate d’éthyle et 5 mL de
cyclohexane.
Mélanger
Mettre papier filtre dans la cuve pour bien saturer en vapeur
Préparer la plaque de silice et déposer :
o Phase orga 1 (+ acétyleugénol)
o Phase orga 2 (acétyleugénol)
o Phase orga 3 (eugénol)
o Eugénol commercial dilué dans un peu d’éluant
Faire migrer l’éluant
Révéler sous UV
La chromatographie sur couche mince permet de caractériser les composés en les comparant
au composé commercial pur.
On se rend compte aussi ici, que le chromato permet de séparer les composés d’un mélange
qui ont des vitesses de migration différentes (cf phase orga 1). La technique de
chromatographie sur colonne permet réellement de séparer les composés d’un mélange

puisque l’on récupère physiquement, dans des béchers séparés, les différents constituants
(mais assez délicate à mettre en œuvre…)
Conclusion
Nous avons vu au cours de ce montage, différentes techniques de séparation, purification et
caractérisation, fréquemment utilisées en chimie. Toutefois, nous n’avons pas pu toutes les
mettre en œuvre, faute de temps. Au niveau caractérisation, on utilise également la mesure du
point de fusion sur banc Köfler ou la mesure de l’indice de réfraction. C’est techniques
nécessitent que le composé soit pur, pour pouvoir comparer la mesure effectuée avec celles
existant dans les tables. Cependant, quand les composés ne sont pas encore connus, on est
obligé d’utiliser des méthodes plus sophistiquées telle la spectrographiques (InfraRouge I.R,
UltraViolets U.V ou Résonance Magnétique Nucléaire RMN), la spectrométrie de masse ... )
BIBLIO
Document d’accompagnement spé-TS
100 manip T2 (orga)
Questions
Q1 Qu’est-ce que l’eau de chaux ? Que se passe-t-il en présence de CO2 ?
R1 L’eau de chaux est une solution aqueuse de Ca2+ + 2OH- saturée. Par ajout de CO2, il se
forme de l’eau et du calcaire (CaCO3).
Q2 : qu’est-ce que l’hydrodistillation ?
R2 : entraîner les composés volatiles des produits naturels avec la vapeur d’eau. Le procédé
d’hydrodistillation est la distillation d’un mélange d’eau et d’un produit naturel. Elle consiste
à porter à ébullition le mélange, puis à condenser les vapeurs qui se dégagent, c’est-à-dire
de les ramener à l’état liquide, afin de récupérer les arômes. Par ailleurs, quelque soit la
nature du composé organique, la température d’ébullition du mélange est inférieure à
100°. On récupère ainsi un mélange de substances organiques et d’eau. La température
du mélange reste constante jusqu’à l’épuisement d’un des réactifs. La température de
chauffage étant assez faible, on ne détruit pas le composé organique
Q3 : différence d’acidité entre un alcool et un phénol ?
R3 : pKa(phénol)=9 pKa(alcool)=16
1
/
4
100%