Les Essentiels 2005, p

Les Essentiels 2005, p. 279-294.
© 2005 Elsevier SAS. Tous droits réservés.
Nausées et vomissements postopératoires
P. Diemunsch *, F. Zohra Laalou
Service d'anesthésie-réanimation, CHU de Hautepierre, 67000 Strasbourg, France
* e-mail : Pierre.diemunsch@chu-strasbourg.fr
POINTS ESSENTIELS
· Les nausées et vomissements postopératoires (NVPO) restent une complication trop
fréquente de la période postopératoire, particulièrement mal vécue en chirurgie ambulatoire.
· Les antagonistes du récepteur 5-HT3 sont les médicaments de référence pour la prise en
charge des NVPO [1]. Le palonosétron, de demi-vie de l'ordre de 40 heures, pourrait venir
compléter ce groupe dans un avenir proche.
· Le dropéridol et la dexaméthasone sont deux autres médicaments approuvés pour le
traitement des NVPO.
· Les antagonistes du récepteur de type 1 de la neurokinine (NK1) ont fait la preuve de leur
intérêt pour la prise en charge des NV chimio-induits (NVCI) et sont en cours de validation
dans les NVPO.
· Les AMM qui restreignent l'emploi des antagonistes du récepteur 5-HT3 au traitement des
symptômes constitués et limitent la prévention des NVPO à l'administration de dropéridol au
cours de la PCA à la morphine, ne sont plus en phase avec les pratiques observées.
· En chirurgie de jour, l'anesthésie au propofol contribue largement à la prévention des
NVPO. Dans ce contexte, les formes orales lyophilisées des antiémétiques sont intéressantes
mais sous utilisées et ignorées des recommandations.
· Les risques cardiaques du dropéridol ont fait l'objet de mentions légales fortes, tant en
France qu'aux États-Unis. Cette question est l'objet d'une vive controverse.
· En dépit d'initiatives soutenues par l'industrie, il n'y a pas de consensus clair pour la prise en
charge des NVPO. Une prophylaxie primaire ou secondaire, fondée sur des scores de risque
validés, semble l'orientation la plus satisfaisante. L'association d'un antiémétique et de
dexaméthasone, qui a déjà montré sa supériorité en NVCI, pourrait représenter le meilleur
choix.
· Au-delà des seules prescriptions médicamenteuses, l'approche multimodale des NVPO est
une alternative séduisante, mais ne parvient pas toujours à accroître la satisfaction des
patients.
DÉFINITIONS

La nausée est une expérience subjective désagréable, caractérisée par un malaise général
souvent accompagné de signes parasympathiques et de l'impression de l'imminence d'un
vomissement.
Le vomissement est un réflexe coordonné au niveau du tronc cérébral par un centre du
vomissement situé à proximité du noyau du tractus solitaire. Son bras efférent implique la
musculature abdominale, le diaphragme, l'œsophage et le système respiratoire.
Durant la période postopératoire, de nombreux facteurs, notamment pharmacologiques,
mécaniques, mnésiques, des signaux d'origine optique et vestibulaire, peuvent contribuer à la
survenue de nausées et de vomissements.
INCIDENCE ET FACTEURS DE RISQUE
Les NVPO surviennent pour moitié après la sixième heure postopératoire et peuvent être
ignorés de l'équipe d'anesthésie. On admet qu'un patient sur trois présente des NVPO et que
35 % des patients de chirurgie ambulatoire sont sujets à des NVPO après avoir quitté
l'hôpital [2] ; elles sont une des causes principales de réadmission inopinée après chirurgie
ambulatoire [3].
Les NVPO peuvent durer plusieurs jours et une évaluation à la 24e heure est insuffisante pour
connaître l'incidence du phénomène.
De nombreux patients déclarent les NVPO comme l'événement le plus déplaisant de leur
intervention et seraient prêts à payer de leurs propres deniers pour les éviter [4].
Indépendamment d'un trouble majeur de la qualité de vie, les NVPO peuvent compromettre le
résultat de la chirurgie et prolonger le séjour en SSPI. Des complications graves, comme la
déhiscence de sutures, la rupture de l'œsophage et la pneumopathie d'inhalation, ont été
rapportées mais restent exceptionnelles.
En ce qui concerne le terrain, seraient plus exposés les femmes, les jeunes, les obèses, les
sujets ayant des antécédents de NVPO et de mal des transports. L'anxiété préopératoire et la
douleur postopératoire sont des facteurs favorisants [5], tandis que l'éthylisme et le tabagisme
seraient protecteurs [6], comme pour les nausées et vomissements induits par la
chimiothérapie (NVCI) et ceux de la grossesse [7]. Les données concernant la phase du cycle
menstruel sont contradictoires.
Les interventions particulièrement prédisposantes comprennent la chirurgie gynécologique,
les laparoscopies, les lithotripsies, la chirurgie ophtalmologique, la chirurgie orthopédique [8].
L'inexpérience de l'opérateur a également été identifiée en tant que facteur favorisant : en
chirurgie ORL, l'incidence rapportée des NVPO a été de 69 % et de 42 % (p < 0,01) selon que
l'acte était pratiqué par un interne ou un spécialiste confirmé [9].
Les médicaments généralement incriminés ne se limitent pas aux produits de l'anesthésie
(notamment morphiniques, halogénés, et étomidate), mais comprennent aussi un certain
nombre de ceux administrés en période périopératoire comme les antibiotiques (notamment
les imidazolés et les macrolides tels l'érythromycine qui possède une activité motiline-
like [10]), les alcaloïdes de l'ergot de seigle et les analgésiques morphiniques. En chirurgie
ambulatoire, l'alfentanil provoque moins de NVPO que le fentanyl et le sufentanil [11].

Lorsque le propofol est associé au rémifentanil, on observe moins de NVPO après chirurgie
plastique que lorsque le fentanyl est l'analgésique choisi [12].
Les anesthésies inhalatoires sont plus émétisantes que les anesthésies intraveineuses
totales [13] et notamment pour les NVPO précoces [14]. Cependant, l'association
systématique d'une prophylaxie antiémétique à l'anesthésie au desflurane permet de ramener
l'incidence des NVPO au niveau de celle de l'anesthésie au propofol [15]. Il semble que
l'ajustement précis des concentrations de sévoflurane à l'aide du monitorage de l'index
bispectral permette de réduire significativement l'incidence des NVPO en chirurgie
laparoscopique ambulatoire [16]. En chirurgie pédiatrique (hernie inguinale), la
rachianesthésie avec sédation au propofol n'apporte pas plus de satisfaction aux patients que
l'anesthésie au sévoflurane, en dépit d'un nombre moins important d'épisodes de NVPO et
d'une meilleure analgésie postopératoire [17].
Plusieurs études révèlent une incidence plus élevée de NVPO chez les patients ayant reçu du
N2O [18]. En chirurgie ambulatoire gynécologique cependant, l'éviction du N2O n'abaisse pas
l'incidence des NVPO et n'apporte aucun bénéfice aux patientes (étude prospective, n =
1 490) [19].
La réversion de la curarisation avait également été incriminée. Plusieurs études contrôlées
notamment en chirurgie ambulatoire ont démenti cette impression [20] [21].
Pour ce qui concerne les anesthésies locorégionales, le risque émétique semble moins
important qu'au décours des anesthésies générales. Les facteurs prédisposants spécifiques sont
mal connus. La prémédication, les adjuvants aux anesthésiques locaux, la sédation associée et
la prise en charge de la douleur postopératoire semblent cependant des éléments déterminants.
Pour ce qui concerne plus particulièrement la rachianesthésie et la péridurale, l'adjonction
d'un opioïde augmente le risque émétique s'il s'agit de péthidine, davantage que s'il s'agit de
morphine, tandis que le sur-risque imputable au fentanyl ou au sufentanil apparaît faible.
L'adjonction de clonidine n'expose pas en soi aux NVPO à la condition de ne pas entraîner
d'hypotension. En revanche, l'administration rachidienne de néostigmine s'accompagne quasi
constamment de NVPO, raison parmi d'autres qui a limité cette pratique [22].
Plusieurs scores ont été proposés pour déterminer quels patients étaient particulièrement
exposés, dans le but de rationaliser les indications d'un traitement prophylactique. Le plus
simple est le score de risque d'Apfel, établi dans le contexte de l'anesthésie inhalatoire. Pour
Apfel [23], le type de chirurgie joue un rôle négligeable par rapport aux facteurs individuels,
déterminants, que sont le sexe féminin, le jeune âge (pré-adolescence), le statut de non-
fumeur, les antécédents de NVPO ou de mal des transports ; et aux deux facteurs liés à
l'anesthésie que sont : la durée supérieure à une heure et l'anesthésie inhalatoire.
En 1999, paraît le score simplifié qui ne retient plus que quatre facteurs déterminants qui
sont : a) le sexe féminin ; b) le statut de non fumeur ; c) les antécédents de NVPO ou de mal
des transports ; d) l'administration postopératoire de morphiniques. La présence de 0, 1, 2, 3,
ou 4 de ces facteurs est associée à des incidences de NVPO de respectivement : 10 % (0) ;
21 % (1) ; 39 % (2) ; 61 % (3) ; et 79 % (4) (tableau I).
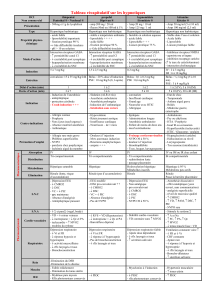
Tableau I. Facteurs de risque de NVPO. Une prophylaxie est préconisée si deux ou plus
des facteurs sont présents. Le type de chirurgie ne fait pas partie des facteurs retenus.

Facteurs de risque de NVPO après anesthésie inhalatoire ; score simplifié d'Apfel
Sexe féminin
Non-fumeur
Antécédents de NVPO ou de mal des transports
Morphiniques postopératoires
Le score simplifié d'Apfel a le mérite d'exister mais ne prend pas en compte des facteurs qui
semblent importants comme le type d'hypnotique (par exemple étomidate vs propofol), les
médicaments associés, la mobilisation postopératoire, le terrain éthylique et l'ensemble des
données spécifiques à telle ou telle unité de soins (cf. supra). C'est pourquoi il a été très
critiqué. En particulier Thomas et al. [24] soulignent la difficulté de classer les tabagiques
sevrés et les patients qui n'ont jamais été opérés. Pour ces auteurs, l'hypothèse nulle à tester
est : « il n'y a pas de différence d'incidence de NVPO entre une population traitée par des
antiémétiques sur la base du score d'Apfel et une population ou la prescription est faite au
hasard ». Cette étude reste à réaliser.
Par ailleurs, les facteurs de risque de nausées ne sont pas identiques aux facteurs de risque de
vomissements. Il a été montré en 2003, sur une série de 671 patients, que les facteurs
prédictifs de nausées et de vomissements sont le sexe féminin, le statut de non-fumeur et
l'anesthésie générale (versus locorégionale), tandis que les facteurs prédictifs de nausées
postopératoires (sans vomissements) sont le terrain migraineux et le type de chirurgie
(gynécologique, abdominale, neurologique, ophtalmologique, maxillofaciale) [25].
Une approche séduisante de la prédiction du risque émétique est possible lorsque l'on dispose
d'un système de recueil informatisé des données anesthésiologiques. Il devient alors possible
d'identifier les facteurs prédisposants locaux, spécifiques de l'hôpital et de l'équipe, de leur
attribuer une valeur prédictive et de calculer pour chaque patient la probabilité de survenue de
NVPO avec correction Bayesienne constante [26].
Indépendamment de la prophylaxie, la stratégie thérapeutique pourrait être améliorée par
l'optimisation du traitement curatif des NVPO au moyen d'associations antiémétiques. La
prescription en première intention d'une telle association serait fondée sur la connaissance des
facteurs de risque de récurrence des épisodes de NVPO après le premier épisode. Il s'agit
d'une véritable prophylaxie secondaire dont les bénéfices humains sont évidents et les
avantages pécuniaires certains si le prix des mesures associées est inférieur à celui de la prise
en charge d'un nouvel épisode. Indépendamment du premier traitement mis en œuvre, les
facteurs prédictifs de la récurrence des NVPO sont le sexe féminin, les antécédents de NVPO,
l'analgésie postopératoire à la morphine et la prémédication sans hydroxyzine [27]. En cas de
récidive de NVPO, il semble préférable de recourir à une classe pharmacologique différente
de celle utilisée initialement. Cette donnée, récemment vérifiée, confirme l'intérêt d'une
association de deux classes d'emblée, pour la prophylaxie secondaire en présence de facteurs
avérés de risque de récurrence [28].
L'association sétron + dexaméthasone ou dropéridol semble particulièrement intéressante
(taux de réponse complète à 24 heures : 94 % pour l'association granisétron 40 mg/kg +
dropéridol 20 g/kg en chirurgie ORL et 98 % pour l'association granisétron 40 mg/kg +
dexaméthasone 150 mg/kg en chirurgie pédiatrique [29]).
PRINCIPAUX TRAITEMENTS

Antagonistes du récepteur de type 3 à la sérotonine (5-HT3)
L'ondansétron (Zophren®), le dolasétron (Anzemet®) dont l'effet est dû au métabolite
principal, l'hydrodolasétron, le granisétron (Kytril®) (dérivé du métoclopramide) et le
tropisétron (Navoban®) sont les principaux représentants de cette classe. Plus récemment, le
palonosétron a été développé pour agir contre les symptômes émétiques tardifs de la
chimiothérapie anticancéreuse. Sa demi-vie est de l'ordre de 40 à 128 heures contre moins de
8 heures pour les autres sétrons [30]. Nous ne disposons pas à ce jour de données sur le
palonosétron dans le contexte des PONV.
L'ensemble des travaux réunis concernant l'ondansétron, les données comparatives par rapport
aux antiémétiques classiques ainsi que l'enregistrement de ce médicament pour l'indication
NVPO dans de très nombreux pays en ont fait la référence actuelle. Les études comparant les
antagonistes des récepteurs 5-HT3 entre eux pour l'indication NVPO sont peu nombreuses et
concluent généralement à l'équivalence des molécules.
Du fait de leur absence d'action sur les récepteurs histaminique, dopaminergique et
cholinergique, ces médicaments puissants sont dépourvus des effets sédatifs, dysphoriques et
cardiovasculaires des butyrophénones (comme le dropéridol), des phénothiazines et des
anticholinergiques et n'entraînent pas les manifestations extrapyramidales observées avec les
fortes doses de benzamides (comme le métoclopramide). Des manifestations dystoniques ont
été rapportées après administration d'ondansétron sans que la relation de cause à effet ne soit
certaine [31]. Les antagonistes du récepteur 5HT3 sont également susceptibles de provoquer
une ischémie myocardique aiguë mais cet effet secondaire reste très exceptionnel et sa
pathogénie est mal expliquée [32].
En ce qui concerne l'ondansétron, de nombreuses études permettent de conclure que la dose
appropriée en prévention comme en traitement des NVPO est de 4 mg par voie intraveineuse.
La prévention orale demande 4 à 16 mg. En chirurgie infantile, la dose prophylactique est de
50 g/kg [33] et la dose thérapeutique de 100 g/kg, sans dépasser 4 mg [34].
Pour le dolasétron [35], la dose recommandée est de 12,5 mg par voie intraveineuse, tant pour
prévenir que pour traiter les NVPO [36] [37]. La prophylaxie des NVPO par le granisétron
intraveineux est efficace pour des doses de 1 mg [38], 20 g/kg [39], 40 g/kg chez
l'adulte [40] et l'enfant [41]. Trois milligrammes (environ 60 g/kg) sont plus efficaces que
1,25 mg de dropéridol pour prévenir les NVPO après cholécystectomie laparoscopique [42].
La dose optimale pour l'indication NVPO demande à être mieux précisée. Il en va de même
pour le tropisétron qui s'est avéré efficace en prévention à la dose de 5 mg par voie
intraveineuse [43] [44] tandis que d'autres travaux ont montré que 2 mg pourraient représenter
la dose idéale dans cette indication [45].
Il a été montré que des taux de réponse équivalents sont obtenus avec des doses moindres
lorsque l'antiémétique est injecté juste avant le réveil anesthésique. Ainsi, 12,5 mg de
dolasétron injectés en fin d'anesthésie, procurent un bénéfice comparable à 50 mg du même
produit administrés avant l'induction [46] [47]. Dans le même ordre d'idée, en chirurgie ORL
ambulatoire, le recours à un médicament de secours était moins souvent nécessaire lorsque 4
mg d'ondansétron sont administrés en fin d'anesthésie plutôt qu'avant l'induction [48]. Ce type
d'avantage n'est pas retrouvé constamment [49] [50].
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%