Contrôle physique

Contrôle physique-chimie n°1 - 30/09/09 Durée : 2h
- Lisez bien les énoncés
- Pour chaque question, donnez le raisonnement suivi : formule littérale + applications numériques + résultat avec les
unités et un nombre correct de chiffres significatifs + phrase brève et précise exprimant le résultat demandé.
CHIMIE : ( 10 pts )
chimie et spéléologie (Liban, Juin 2004)
Dans le cadre d’un projet pluridisciplinaire sur le thème de la spéléologie, des élèves de terminale doivent faire
l’exploration d’une grotte où ils risquent de rencontrer des nappes de dioxyde de carbone CO2. A teneur élevée, ce gaz peut
entraîner des évanouissements et même la mort. Le dioxyde de carbone est formé par action des eaux de ruissellement acides sur le
carbonate de calcium CaCO3 présent dans les roches calcaires. Le professeur de chimie leur propose d’étudier cette réaction.
Données :
Température du laboratoire au moment de l’expérience : 25°C soit T = 298 K
Pression atmosphérique : Patm = 1,020.105 Pa
Loi des gaz parfaits : PV = nRT
Constante des gaz parfaits : R = 8,31 SI
Masses molaires atomiques, en g.mol-1 : M(C) = 12 ; M(H) = 1 ; M(O) = 16 ; M(Ca) = 40
Densité d’un gaz par rapport à l’air : d = M/29, où M est la masse molaire du gaz
Dans un ballon, on réalise la réaction entre le carbonate de calcium CaCO3 (s) et l’acide chlorhydrique (H3O+ + Cl- (aq)). Le
dioxyde de carbone formé est recueilli, par déplacement d’eau, dans une éprouvette graduée.
Un élève verse dans le ballon un volume VS = 100 mL d’acide chlorhydrique à 0,10 mol.L-1. A la date t = 0s, il introduit rapidement
dans le ballon 2,0 g de carbonate de calcium tandis qu’un camarade déclenche le chronomètre. Les élèves relèvent les valeurs du
volume V(CO2) de dioxyde de carbone dégagé en fonction du temps. Elles sont répertoriées dans le tableau ci-après. La pression du
gaz est égale à la pression atmosphérique.
t(s)
0
20
40
60
80
100
120
140
160
180
200
220
V(CO2)
0
29
49
63
72
79
84
89
93
97
100
103
t(s)
240
260
280
300
320
340
360
380
400
420
440
V(CO2)
(mL)
106
109
111
113
115
117
118
119
120
120
120
La réaction chimique étudiée peut être modélisée par l’équation :
CaCO3(s) + 2 H3O+ Ca2+(aq) + CO2(g) + 3 H2O(solv)
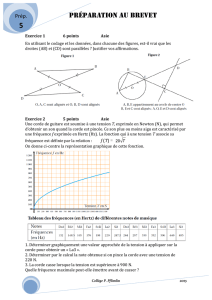
1. Calculer la densité par rapport à l’air du dioxyde de carbone. Dans quelles parties de la grotte ce gaz est-il susceptible de
s’accumuler ?
2. Déterminer les quantités de matières initiales de chacun des réactifs.
3. Dresse le tableau d’avancement de la réaction. En déduire la valeur xmax de l’avancement maximum. Quel est le réactif
limitant ?
4. Exprimer l’avancement x de la réaction à une date t en fonction de V(CO2), T, Patm et R. Calculer sa valeur numérique à la
date t = 20s.
5. Calculer le volume maximum de gaz susceptible d’être recueilli dans les conditions de l’expérience. La transformation est-
elle terminée ?
6. Les élèves ont calculé les valeurs de l’avancement x et reporté les résultats sur le graphe donné en annexe (à rendre avec la
copie).
a. Donner l’expression de la vitesse volumique de réaction en fonction de l’avancement x et du volume VS de
solution. Comment varie la vitesse volumique au cours du temps ? Justifier à l’aide du graphe.
b. Déterminer la vitesse volumique à l’instant t = 120 s.
c. Définir le temps de demi réaction t1/2. Déterminer graphiquement sa valeur.
7. La température de la grotte qui doit être explorée par les élèves est inférieure à 25°C.
a. Quel est l’effet de cet abaissement de température sur la vitesse volumique de réaction à la date t = 0s.
b. Tracer sur le graphe fourni en annexe l’allure de l’évolution de l’avancement en fonction du temps dans ce cas.

x = f(t)
0
1
2
3
4
5
6
0
20
40
60
80
100
120
140
160
180
200
220
240
260
280
300
320
340
360
380
400
420
440
t (min)
x (mmol)
x = f(t)
0
1
2
3
4
5
6
0
20
40
60
80
100
120
140
160
180
200
220
240
260
280
300
320
340
360
380
400
420
440
t (min)
x (mmol)

PHYSIQUE : ( 10 pts)
Propagation d’une onde ( D’après bac Asie 2005 )
1. Une très longue corde élastique est disposée horizontalement sur le sol. Un opérateur crée une secousse verticale à l’extrémité
S de la corde. (fig. 1) .
a) Préciser la direction de propagation de l’onde et la direction du mouvement du point M.
b) En déduire si l’onde est transversale ou longitudinale.
2. La propagation de l’onde le long de la corde est étudiée par chronophotographie (fig. 2). L’intervalle de temps séparant deux
photos consécutives est Δt = 0,25 s.
a) Définir, puis calculer la célérité de l’onde.
b) Pendant quelle durée un point de la corde est-il en mouvement ?
3. l’évolution au cours du temps des altitudes ZA et ZB de deux points A et B de la corde est l’objet de la figure 3. l’instant de date
t0 = 0 s correspond au début du mouvement de S. toutes les réponses doivent être justifiées.
a) Lequel de ces deux points est touché le premier par la perturbation ?
b) Lequel de ces deux points est situé le plus près du point S de la corde ?
c) Quel retard le point touché en second présente-t-il dans son mouvement par rapport au point touché en premier ?
d) Quelle est la valeur de la distance séparant les points A et B ?
e) Un troisième point C commence son mouvement à l’instant tC = 0,50 s. Préciser sa position par rapport à A.
Représenter sur un schéma la position des points A, B et C (échelle 2 cm pour 1 m ) par rapport au point source S.
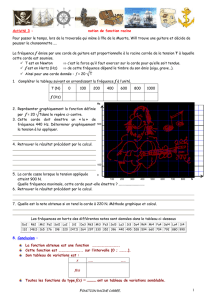
4. Les courbes ci-dessous (fig. 4, 5 et 6 ) donnent l’évolution au cours du temps du déplacement vertical d’un point K d’une corde
situé à la distance fixe d = SK du point S. l’instant de date t0 = 0 correspond au début du mouvement de S. Les conditions
expérimentales sont précisées pour chauqe expérience. Toutes les réponses doivent être justifiées en utilisant les
représentations graphiques.
a) La tension de la corde utilisée est la même dans les deux expériences 1-a et 1-b. La forme de la perturbation
modifie-t-elle la célérité ?
b) La même corde est utilisée dans les expériences 2-1 et 2-b. Lors de l’expérience 2-a, la tension de la corde
modifie-t-elle la célérité, et si oui, dans quel sens ?
c) Rappel : la masse linéique μ est la masse par unité de longueur ; pour une corde de masse M et longueur L, on a
donc μ = M / L. La tension est la même dans les deux dernières expériences ; la masse linéique de la corde utilisée
pour l’expérience 3-a est plus faible que celle utilisée pour l’expérience 3-b. la masse linéique de la corde modifie-
t-elle la célérité et si oui, dans quel sens ?

1
/
4
100%