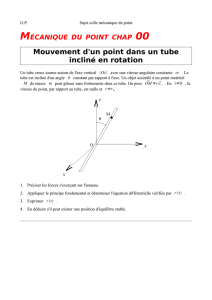
TP 6

TP C1 L’ELEMENT CUIVRE « DANS TOUS SES ETATS »
NOM :
PRENOM :
BINOME :
Remarque préliminaire : lorsqu’une espèce chimique est sous forme solide, on note (s) en indice, ex : Cu(s)
liquide, on note () en indice, ex : HNO3()
gazeuse, on note (g) en indice, ex : NO2(g)
ionique dans l’eau, on note (aq) en indice, ex : Cu2+(aq)
Expérience n°1) Action de l’acide nitrique sur le métal cuivre : SOUS LA HOTTE !
Dans un tube à essai, placer un copeau de métal cuivre : Cu(s)
Mettre des gants et verser dans le tube à essai environ 2 mL d'une solution d'acide nitrique concntrée : HNO3()
Boucher le tube à essai avec le bouchon fourni, agiter, reposer le tube à essai puis ôter le bouchon.
ATTENTION, LE GAZ ROUX QUI S’ECHAPPE EST : NO2(g)
Compléter les deux schémas en indiquant la formule des espèces chimiques présentes et en notant les couleurs observées :
La solution obtenue est homogène de couleur ………………………..
L'espèce chimique responsable de cette couleur est l’ion cuivre (II) dont la formule chimique est Cu2+(aq).
La solution obtenue est appelée solution 1.
Expérience n°2) Action de la soude sur la solution 1
Verser 1 mL de la solution 1 dans un tube à essai.
Mettre des gants et ajouter lentement dans le tube environ 1 ml d'hydroxyde de sodium concentrée : Na+(aq),HO-(aq)
Compléter les deux schémas en indiquant la formule des espèces chimiques présentes et en notant les couleurs observées :
On obtient un précipité ……………..……. C’est de l’hydroxyde de cuivre (II) : Cu(OH)2(s). On le note solide 2.
Expérience n°3) Décomposition du solide 2 par la chaleur (= deshydratation)
Chauffer modérément le tube jusqu’à ce que tout le solide 2 change de couleur.
Mettre des lunettes pour se protéger des projections éventuelles.
Compléter les deux schémas en indiquant la formule des espèces chimiques présentes et en notant les couleurs observées :
On obtientun solide ..………..……. C’est de l’oxyde de cuivre (II) : CuO(s). On le note solide 3.
Réactifs :
Produits :
Réactifs :
Produits :
Réactifs :
Produits :
Objectif : observer et décrire plusieurs formes prises
par l’élément Cuivre au cours de plusieurs réactions
chimiques.

Expérience n°4) Action de l’Acide Chlorhydrique sur le solide 3
Refroidir le tube à essai sous un robinet.
Mettre des gants et ajouter lentement dans le tube environ 2 d’acide chlorhydrique concentré : H+(aq),Cl-(aq)
Boucher le tube et agiter doucement.
Compléter les deux schémas en indiquant la formule des espèces chimiques présentes et en notant les couleurs observées :
On obtient une solution de couleur ………………………………...……. Cela indique la présence de ……………………………………………….
Expérience n°5) Action du fer métal sur la solution 4
Introduire dans le tube à essai un peu de paille de fer : Fe(s)
Compléter les deux schémas en indiquant la formule des espèces chimiques présentes et en notant les couleurs observées :
On obtient un dépôt de couleur ..…………………....…. sur la paille de fer. C’est du ……..………………..
6) Bilan de toutes les réactions chimiques précédentes
Compléter les schémas en indiquant le nom et la formule de l’espèce chimique contenant l’élément cuivre Cu :
Conclusion : le point commun de toutes les espèces chimiques rencontrées ci-dessus est …………..….
Ainsi, au cours d’une réaction chimique, les éléments chimiques ne disparaîssent pas, ils se …………………
On dit qu’il y a ……………………………………… des éléments chimiques au cours d’une réaction.
Réactifs :
Produits :
Réactifs :
Produits :
expérience n°1
nom :
formule :
nom : métal cuivre
formule : Cu(s)
expérience n°2
expérience n°3
nom :
formule :
nom :
formule :
nom :
formule :
expérience n°5
expérience n°4
1
/
2
100%