cours du 22-01

Master d’immunologie / 22Janvier 2008 Ronéotypeuses : CHAMPEL Marie
17h – 19h MAZERAND Sandie
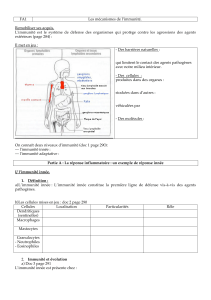
LES CELLULES NATURAL KILLERS
Nous tenons à vous dire avant de commencer, que cette ronéo a été réalisée sans diaporama
(tjs pas dispo sur le site de la l’université Paris V, grrr) donc à partir de nos notes, du
dictaphone et de nos connaissances. Le prof s’est énormément répété pendant ces deux heures
de cours et nous avons essayé de ne pas en faire autant… Bonne lecture !! Et n’hésitez pas à
rajouter des éléments que nous aurions oubliés. Les parties I et II sont celles sur lesquelles
nous sommes plus susceptibles d’être interrogés, la troisième étant plus pour nous motiver à
faire de la recherche… (Ou pas).
Plan, à titre indicatif :
Introduction
I – Les deux types d’immunité
1°) Immunité innée
2°) Immunité adaptative
3°) Différences et similitudes
II – La cellule NK
1°) Description
a. Mode d’action
b. Rôles et déficit
c. Récepteurs
d. Régulation
e. Autres types de récepteurs
2°) Activation et maturation des cellules NK
III – Applications et projets thérapeutiques

Introduction
Le concept des cellules NK nécessite la mise en place et la compréhension d’une
balance entre la défense du soi (ou attaque) d’une part et la tolérance (ou auto-immunité) du
non soi d’autre part.
Dans les mécanismes d’attaque et de défense, on a affaire à des systèmes complexes
qui partent d’une Immunité, appelée « Immunité naturelle », qui au cours de l’évolution des
espèces, s’est développé en ce qu’on appelle l’ « Immunité adaptative ».
En effet, en partant du règne des plantes, à celui des animaux puis à celui de l’Homme,
la nature a progressivement répondu différemment face à une infection. Le premier moyen
d’ailleurs de lutte contre une agression infectieuse est la mort. Si l’on prend le règne des
plantes, le moyen dont elles vont disposer pour se défendre en réponse à une infection est le
mécanisme d’apoptose.
C’est en se suicidant que les cellules infectées vont limiter la dispersion de l’épidémie.
Puis après, avec l’Immunité naturelle, les cellules vont mettre en place la défense, et enfin,
avec l’Immunité adaptative, elles vont pouvoir organiser l’attaque.
I- Les deux types d’immunité
Avant tout, qu’est-ce que l’immunité ? C’est la capacité de l'organisme à se défendre
contre une agression infectieuse ou une maladie donnée. Autrement dit, il y’a là la notion
d’Antigène (Ag), de non soi. Le concept que nous devons avoir de l’Ag est très important
cette année. La répartition de l’Ag se fait à travers deux concepts :
D’une part .les Ag du soi, ceux qui sont présents sur et dans les cellules de notre corps ;
.les Ag du non soi, ce qui est étranger à notre organisme.
Et d’autre part, l’univers dans lequel nous vivons, se décompose avec deux séries de signaux :
. Les signaux de danger ou de stress, par exemple les modifications climatiques ;
. L’infection.
Si on prend ces quatre concepts, on aboutit à une série d’Ag :
- les Ag du soi inoffensifs
- les Ag du soi dangereux
- les Ag du non soi qui sont dangereux
- les Ag du non soi qui sont infectés…
Ainsi on aboutit à toutes les catégories prédictives donnant la manière dont un Ag
peut à la fois réagir soit au niveau du soi, soit au niveau du non soi en fonction des signaux de
danger ou des signaux d’infection.

1°) Immunité Innée
C’est une immunité observée du point de vue de l’évolution.
La première question qui s’est posée a été de savoir si on pouvait reconnaître
l’étranger avant de se reconnaître soi-même. Autrement dit : l’étranger a-t-il été reconnu
plus que le soi ?
En effet, notre organisme est capable de reconnaître l’étranger sans pour autant avoir
besoin de se reconnaître soi même. Puis, petit à petit, l’évolution a fait en sorte qu’à travers la
présentation des peptides par le Complexe Majeur d’Histocompatibilité (CMH), un deuxième
concept : la reconnaissance du soi s’est développé.
Cette immunité innée est née d’un concept pour réagir contre l’étranger. Elle est, dans
le règne évolutif, la deuxième à s’être mis en place( la première étant celle concernant
l’apoptose ou « suicide cellulaire »). Elle est apparue il y a environs 600 millions d’années,
avec toute une série de facteurs sériques, le complément… qui ont eu des actions diverses sur
la réaction contre les microbes, la coagulation.
Entre 600 et 450 millions d’années, on a remarqué que la défense contre l’agression
infectieuse chez les espèces de cette période se faisait essentiellement à travers l’immunité
naturelle. Et ce n’est qu’il y a 450 millions d’années, que l’on voit apparaître avec le règne du
requin, une immunité adaptative (cf. I-2°)).
En résumé, l’immunité naturelle a dominé l’évolution des espèces pendant ces 150
millions d’années et est restée présente jusqu’à il y a 450 millions d’années.
2°) Immunité adaptative
C’est une immunité observée du côté des mammifères.
Elle a été découverte en 1960 à partir du concept de la théorie clonale. En fait, les
cellules se mettent à proliférer et à se développer avec des réarrangements « que vous
connaissez »…mouais. Et elles se développent en réaction avec l’étranger.
La question qui s’est alors posée a été : pourquoi un clone, comment s’est-il
développé et comment s’effectue la coopération cellulaire avec les macrophages, les cellules
T, les cellules B…
3°) Différences et similitudes
Le premier élément à noter est que les deux immunités se différencient par un certain
nombre de facteurs, résumé dans ce tableau récapitulatif :

Immunité Innée Immunité Adaptative
Effecteurs Cellules NK, Cellules B et T
Cellules dendritiques, Cellules dendritiques
Complément (sérique)
Reconnaissance Par polymorphisme des Par réarrangement génique,
récepteurs. mutation, association
combinatoire.
Variabilité Variabilité génétique Variabilité génétique
Récepteurs Polymorphisme dans le génome Réarrangements
fixé
Distribution des Non clonale Clonale
Récepteurs
Eléments de Niveaux moléculaires conservés détails de la structure molé-
reconnaissance (LPS, radicaux…) culaire (peptides,protéines)
Discrimination Immédiate Temps de latence
Soi/ non soi
Temps d’action et Immédiat Non immédiat
de l’effet
Réponse Via chimiokines et Mécanismes d’attaque
cytokines.
Commentaire du tableau :
Les deux systèmes sont avant tout complémentaires : l’un va agir de façon
immédiate, dès la pénétration de l’élément étranger, tandis que l’autre se met en place avec du
retard.
Ainsi l’immunité innée est développée en permanence contrairement à l’immunité
adaptative. La première est plus efficace pour éliminer une quantité de cellules infectées ou
tumorales et la deuxième prend le relais lorsque l’immunité innée est dépassée.
Reprenons les différents critères de différenciation :
La reconnaissance est la manière dont les effecteurs sont capables de déceler des Ag.
La différence de reconnaissance associée à la variabilité des récepteurs fait qu’on a affaire à
un mécanisme complexe qui a permis l’adaptation et donc des réponses plus spécifiques et
moins faciles (immunité adaptative) par rapport à un système de réponse de défense plus
larges (immunité innée).
Concernant les récepteurs, dans l’adaptatif : leurs réarrangements ont lieu car il existe
des séries de gènes mis « bout à bout », à la chaîne… et dans l’immunité naturelle : il n’est

pas nécessaire de réarranger pour avoir des récepteurs à la surface des cellules Natural Killers
(cellules NK), ils sont « fixés » dans le génome.
La distribution permet de dire que tous les récepteurs de l’immunité innée, quand ils
s’expriment sont identiques ; tandis que tous les récepteurs de l’immunité adaptative sont
régis selon une loi de distribution clonale : impliquant développement, puis prolifération, puis
différenciation à partir d’une cellule contenant un réarrangement particulier ; tous les
récepteurs sont différents.
Enfin, la discrimination est immédiate pour l’innée et exige un temps de latence afin
d’activer les effecteurs pour l’adaptative impliquant : activation/prolifération/migration.
La réponse quand à elle se fait pour l’immunité naturelle via des informations
véhiculées par :
- les chimiokines : attirent les molécules sur le lieu d’impact étranger, de stress ou
anormal
- les cytokines : induisent la prolifération des cellules.
Rmq : L’immunité innée est peu utilisée en thérapeutique. Etant donné le principe du vaccin,
on va s’appuyer sur l’immunité adaptative qui repose sur le développement de la
mémoire. C’est parce qu’on est capable de développer une mémoire immunitaire, que
le vaccin va être efficace.
II- Les cellules Natural Killers (Cellules NK)
Dans cette notion d’immunité naturelle de reconnaissance ou de discrimination,
comment peut-on à la fois se défendre contre un agresseur et ne pas détruire les cellules de soi
même ?
C’est le « phénomène du Yin et du Yang »( !! Délire du prof).
C'est-à-dire qu’à tout moment, les cellules reçoivent deux séries d’informations : des infos
positives qui leur indiquent de tuer et des infos négatives qui leur disent de ne pas le faire.
La résultante de l’ensemble correspond à des milliards de cellules de ce type qui sont
en train de « patrouiller » , en train de toucher les cellules et qui reçoivent au même moment
une double info.
Il existe deux moyens pour qu’une cellule devienne la cible d’une cellule NK : avec un
signal positif plus fort, ou avec une diminution du signal négatif.
Cela amène une question fondamentale : quels sont les récepteurs qui reçoivent les
signaux positifs ou au contraire qui reçoivent les signaux négatifs ?
Reconnaître le soi du non soi est probablement l’une des questions les plus
intéressantes (si tu le dis !) et des plus compliquées, avec des difficultés de manipulation pour
trouver les mécanismes capables de les stimuler à travers de tels signaux.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%