Document

1
2S Cours Chimie
Action des SOLUTIONS ACIDES sur les METAUX : couple H+ / H2
Après avoir étudié l’action des cations métalliques sur les métaux Nous allons voir ici action des solutions acides sur métaux
C’est le cation H+ qui caractérise une solution acide ; celui-ci est l’oxydant d’un couple rédox qui sert de référence pour la
classification.
I. SOLUTIONS ACIDES
1. Acidité d’une solution
Le pH d’une solution se détermine en utilisant un pH.mètre, du papier pH ou un indicateur coloré (la couleur dépend du pH).
Une solution acide est une solution qui contient des ions hydrogènes H+ en quantité importante. Son pH < 7.
Ex. : coca, vin blanc, vinaigre, limonade, jus de fruit…
2. Choix d’une solution acide
2 possibilités :
- solution acide chlorhydrique (H+, Cl-)
- solution d’acide sulfurique diluée et froide (2 H+, SO42-) : 2 H+ diacide
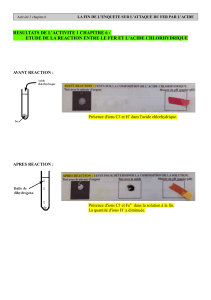
3. Action de (H+, Cl-) sur quelques métaux
Tests
Fe
Zn
Cu
allumette :
observation et
conclusion
soude :
observation et
Conclusion
(H+, Cl-)
…
…
Fe, Cu
ou Zn
Allumette
allumée
Test à la
soude
Une explosion caractérise
la présence de H2
pH
7
0
14
Solutions ……………………
Solutions ……………………
Solutions
…………

2
4. Interprétation
- L’oxydation du fer par une solution acide produit un dégagement de ……………………………………. et conduit à la formation
d’ions ……………………….. selon l’équation-bilan : ……………………………………. (1)
- L’oxydation du Zn par une solution acide produit un dégagement de ……………………………………. et conduit à la formation
d’ions ……………………….. selon l’équation-bilan : ……………………………………. (2)
- Les ions hydrogène H+ contenus dans les solutions acides ne sont pas capables d’oxyder le métal ………………………..
Rem. : Les anions chlorure (Cl-) ou sulfate (SO42-), présents respectivement dans les solutions d’acide chlorhydrique et sulfurique, ne
participent pas aux réactions. Ils sont dits spectateurs (ou indifférents).
II. Un NOUVEAU COUPLE Oxydant / Réducteur : le couple H+aq / H2
L’expérience n°1 montre que Fe → Fe2+ + 2 e- (oxydation du Fe) et que 2 H+ + 2 e- → H2 (réduction de H+)
Le bilan : 2 H+ + Fe → H2 + Fe2+ (transfert d’électrons) est donc une réaction d’oxydo-réduction où les ions H+ sont réduits en H2
1. Mise en évidence du couple H+aq / H2
Interprétation : écrire les 2 demi-équations
électroniques et l’équation bilan de la réaction
supposée :
Cette réaction est donc une réaction d’oxydo-
réduction où ………………… est oxydé en
…………………………….
Conclusion :
L’ion hydrogène est un oxydant dont le réducteur conjugué est le dihygrogène. Ils forment un couple rédox H+ / H2 dont la demi-
équation électronique est 2 H+ + 2 e- H2
2. Place du couple H+ / H2 dans la classification électrochimique
Les expériences précédentes permettent de situer le couple H+/ H2 dans la classification.
L’ion H+ oxyde le ………..….. et le ……………… mais ne peut oxyder le ………………..
On en déduit (règle du gamma) que :
H+ est un oxydant plus ………………… que Fe2+ et Zn2+ mais plus ……………….….. que Cu2+.
(ou H2 est un réducteur plus……………….…….. que Fe et Zn mais plus ……………….. que Cu)
Le couple H+/ H2 est donc situé entre les couples ………….. et ……………..
3. Prévision de l’action des acides sur les métaux
a. Les métaux des couples redox situés …………………………..du couple H+/ H2 (Pb, Fe, Zn, Al, Mg, etc.) réagissent avec les
solutions acides à anion non oxydant (H+, Cl-) ou (2 H+, SO42-) pour donner des cations métalliques (Pb2+, Fe2+, Zn2+, Al3+, Mg2+) et un
dégagement de dihydrogène (H2 ↑).
b. Les métaux des couples redox situés …………………………….du couple H+/ H2 (Cu, Ag, Au = Or, etc.) ne réagissent pas avec
les solutions acides à anion non oxydant (H+, Cl-) ou (2 H+, SO42-).
Cu2+
Cu
Fe2+
Fe
Pouvoir
oxydant
Ag+
Zn2+
Ag
Zn
(H+, Cl-)
…
…
Fe
Papier
imprégné de
(Ag+, NO3-)
H2
Observation :
…………………………
…………………………

3
2S Cours Chimie
Action des SOLUTIONS ACIDES sur les METAUX : couple H+ / H2 :
Exercice
Ex1 : Action de l’acide chlorhydrique sur le zinc
On verse 200 cm3 d'une solution d'acide chlorhydrique (H+, Cl-) sur 4,0 g de grenaille de zinc. Quand la réaction est terminée, on
recueille 1,12 L de dihydrogène, volume mesuré dans les conditions normales où Vm = 22,4 L/mol..
1) Ecrire l'équation-bilan de la réaction.
2) Comment identifier les ions métalliques formés ?
3) Quelle est la concentration des ions zinc (II) dans la solution à la fin de la réaction ?
4) Reste-t-il du zinc métallique non oxydé ? Si oui, quelle est la masse restante ?
Rem : pour les questions 3) et 4) vous pouvez (devez ?) vous aider d’un tableau d’avancement
1
/
3
100%