2. Une réaction est-elle toujours totale?.

Guibal Bellevue TS ch : 2. La transformation d’un système chimique est-elle toujours totale ? 1/5
Partie B : La TRANSFORMATION d’un SYSTEME CHIMIQUE
est-elle toujours TOTALE ?
Les savoir-faire
1- Une transformation chimique n'est pas toujours totale et la réaction a lieu dans les deux sens
(carte mentale) (version imprimable)
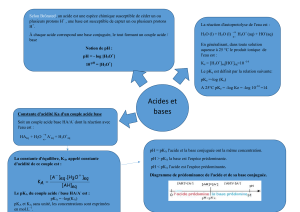
Définir un acide ou une base selon Brönsted.
Ecrire l'équation de la réaction associée à une transformation acido-basique et identifier dans
cette équation les deux couples mis en jeu.
Connaître la définition du pH pour les solutions aqueuses diluées.
Connaissant la valeur de la concentration et du pH d'une solution d'acide, calculer l'avancement
final de la réaction de cet acide sur l'eau et le comparer à l'avancement maximal.
Connaître la définition du taux d'avancement final et le déterminer par une mesure.
2- Etat d'équilibre d'un système (carte mentale) (version imprimable)
Utiliser la relation liant la conductance G aux concentrations molaires effectives [Xi] des ions Xi
Savoir que, lorsque l'état d'équilibre du système est atteint, les quantités de matière n'évoluent
plus, et que cet état d'équilibre est dynamique.
En disposant de l'équation d'une réaction, donner l'expression littérale du quotient de réaction Qr
Savoir que le quotient de réaction dans l'état d'équilibre d'un système, Qréq , prend une valeur,
indépendante de la composition initiale, qui est la constante d'équilibre associée à la réaction.
Savoir que, pour une transformation donnée, le taux d'avancement final dépend de la constante
d'équilibre et de l'état initial du système.
3- Transformations associées à des réactions acido-basiques en solution aqueuse (carte mentale)
Savoir que Ke , est la constante d'équilibre de la réaction d'autoprotolyse de l'eau.
Connaissant la valeur du pH d'une solution aqueuse, dire si elle est acide, basique ou neutre.
A partir de la concentration molaire [ H3O+ ] ou [ HO– ], déduire la valeur du pH de la solution.
Associer la constante d'acidité KA à l'équation de la réaction d'un acide sur l'eau.
Déterminer la constante d'équilibre associée à l'équation d'une réaction acido-basique à l'aide des
constantes d'acidité des couples en présence.
Connaissant le pH d'une solution aqueuse et le pKA du couple acide/base indiquer l'espèce
prédominante; application aux indicateurs colorés.
Réaliser par suivi pH-métrique le titrage d'un acide ou d'une base en solution aqueuse. (animation
flash "méthode des tangentes" réalisée par Theobromine )
Déterminer, à partir d'une expérience, le volume versé à l'équivalence lors d'un titrage acide-
base. Montrer qu'un indicateur coloré convenablement choisi permet de repérer l'équivalence.
1- EQUILIBRE CHIMIQUE, quotient de réaction Qr et constante d’équilibre K
1- 1 Réactions acido-basique
Couple acide/base au sens de Brönsted
Un acide est une espèce chimique susceptible de céder un ou plusieurs protons H +
Une base est une espèce chimique pouvant capter un ou plusieurs protons H +.
Un couple acido-basique est constitué d’un acide et de sa base conjuguée, reliés par la demi-
équation : acide = base + n.H +
Une espèce pouvant être à la fois une base est un acide est une espèce amphotère (ou ampholyte).
Réaction entre 2 couples acide/base : transfert de proton
Une réaction acido-basique a lieu entre deux couples acide / base A1/B1 et A2/B2 . L'acide du couple 1
réagit (transfert d’un H +) avec la base du couple 2 pour donner la base du couple 1 et l'acide du couple 2.
A1 + B2 = B1 + A2

Guibal Bellevue TS ch : 2. La transformation d’un système chimique est-elle toujours totale ? 2/5
1- 2 Définition du pH : relation entre pH et [ H3O+ ]
Le pH est une grandeur sans dimension comprise entre 0 et 14 qui indique si une solution est acide
(pH<7), neutre (pH=7) ou basique (pH>7). Un solution très acide traduit une présence importante d’ions
oxonium : H3O+ . Ainsi plus [ H3O+ ] est
importante, plus la solution est acide, ce qui
implique que la valeur du pH sera faible.
Pour des solutions diluées,(1
pH
13), le pH
est défini par la relation pH = -log[ H3O+ ] où la concentration en ion oxonium est exprimée en
mol/L. Ainsi, nous avons aussi : [ H3O+ ] = 10-pH
1- 3 Etat d’équilibre d’un système chimique
Réversibilité d’une réaction
Pourquoi aboutit-on à un équilibre si on mélange deux réactifs A et B ?
1- 4 Avancement final : xf
Une fois l'équilibre chimique obtenu, les proportions en réactifs et produits ne changent plus : on se trouve
à l'état d'équilibre du système chimique. Il se peut qu’aucun des réactifs n’ait totalement été transformé
alors que le système cesse d’évoluer : dans ce cas la réaction n’est pas totale, elle est dite « limitée ».
On peut, à ce moment là, mesurer l’avancement final xf (par une mesure de pH par exemple).
Maintenant, dans le tableau d’avancement, on n’utilisera que xf . On aura toujours xf
xmax.
1- 5 Taux d’avancement final : τ
Afin d’évaluer si une réaction est totale ou limitée (un peu, beaucoup, …), on détermine le taux
d'avancement final noté par la lettre tau : τ .Ce nombre est sans dimension compris entre 0 et 1, avec 1 qui
correspond à 100%, c'est-à-dire quand xf = xmax , ce qui correspond à une réaction totale.
Ce taux dépend de l’état initial du système et de la constante d’équilibre K
(voir plus loin), et donc de la température.
maxxxf

Guibal Bellevue TS ch : 2. La transformation d’un système chimique est-elle toujours totale ? 3/5
1- 6 Quotient de réaction : Qr
Soit la réaction suivante : a A(aq) + b B(aq) = c C(aq) + d D(aq) avec a, b, c, d les nombres
stœchiométriques et A, B : les réactifs et C et D : les produits. Le quotient de réaction Qr de cette réaction
(à un instant quelconque de son évolution) est défini par :
Ce quotient de réaction est sans unité. Les nombres qui correspondent à [A] ou [B]
sont les mêmes nombres que les concentrations molaires (exprimées en mol.L-1) des
entités chimiques A ou B sauf que ces nombres sont sans dimension. De plus, on admettra que le solvant
(eau) et les corps solides n'interviennent pas dans le quotient de réaction. ( [H2O] = 1 et [entité]s = 1).
1- 7 Constante d’équilibre d’un système chimique: K
Lorsqu'un système chimique atteint son état d'équilibre (les concentrations en réactifs et produits
n'évoluant plus), son quotient de réaction Qréq prend une valeur indépendante de la composition
initiale (à la différence du taux d'avancement). Cette valeur se calcule en prenant les concentrations
obtenues à l’équilibre, c'est-à-dire en utilisant les quantités de matière indiquées dans l’état final (E. F.)
du tableau d’avancement. Cette valeur, notée K, est la constante d’équilibre associée à l’équation de
la réaction considérée. Comme K = Qréq , cette constante est donc également sans unité. Elle n'est
fonction que de la température. Une réaction est quasi totale si K > 103 .
2- TRANSFORMATIONS ACIDO - BASIQUES
2- 1 Equilibre de dissociation d’un acide HA dans l’eau
Etude de la réaction d’un acide HA dans l’eau :
Soit un couple acide / base HA / A- dont la réaction avec l'eau est : HAaq + H2O = A-aq + H3O+aq
Constante d’acidité : KA (notion de pKA)
La constante d'équilibre K associée à cette réaction particulière est
notée KA. C’est la constante d'acidité qui est propre au couple
HA / A-. Elle se calcule selon la relation :
A partir de KA , on définit le pKA tel que :
pKA = - log(KA)
A concentration apportée C égale, plus KA est grand, plus
l'acide AH est dissocié, plus l’acide est fort, plus pKA est
faible, plus le pH de la solution est faible et plus le taux
d’avancement τ de la réaction est grand.
De cette définition, découle la relation entre
le pH et le pKA :
Diagramme de prédominance
Cette dernière relation permet d’établir le diagramme de prédominance : axe qui indique la présence plus
ou moins importante d’un acide par rapport à sa base conjuguée selon les valeurs de pH de la solution.
En effet, dans le cas particulier où le pH de la solution est
égal au pKA du couple acide/base, la relation indique que
log ([base]/[acide]) = 0, d’où [base]/[acide] = 1 ce qui
revient à dire que [base] = [acide]. Ainsi, si pH = pKA
l'acide et la base conjuguée ont la même concentration.
Si pH > pKa la base est l'espèce prédominante.
Si pH < pKA l'acide est l'espèce prédominante.
Voir l’animation par le lien : vidéo

Guibal Bellevue TS ch : 2. La transformation d’un système chimique est-elle toujours totale ? 4/5
Le diagramme de distribution des espèces acide et basique,
représente les pourcentages de l'acide , et de sa base conjuguée, en
fonction du pH de la solution.
Les indicateurs colorés
Les indicateurs colorés sont constitués par des couples acide / base
(souvent notés HInd / Ind- ) particuliers car les espèces conjuguées
ont des teintes différentes. Pour les pH < pKA – 1 , l'indicateur
coloré a sa teinte acide. Pour les pH > pKA + 1 , l'indicateur
coloré a sa teinte basique.
Prenons l’exemple de l’hélianthine
dont la zone de virage est comprise
entre pKa – 1 et pKa + 1 environ
(soit entre 2,4 et 4,4 )
2- 2 Produit ionique de l’eau
Autoprotolyse de l’eau
La réaction d'autoprotolyse de l'eau est la réaction d’un acide particulier : l’eau (du couple H2O / HO-aq)
dans l’eau : H2O + H2O = HO-aq + H3O+aq
L'eau pure possède un pH = 7 à 25°C. Par conséquent les concentrations en ion oxonium et hydroxyde
sont à cette température : [H3O+] = [HO-] = 10-7 mol.L-1
La réaction d'autoprotolyse de l'eau est très limitée (son taux d'avancement final f est très inférieur à 1).
Produit ionique de l’eau Ke
La constante d'équilibre correspondant à l'autoprotolyse de l'eau est la constante d’acidité du couple
particulier H2O / HO-aq. Elle est notée Ke, et est appelée produit ionique de l'eau. À 25 °C , la valeur de
Ke est : Ke = [H3O+]eq[HO-]eq = 10-14 ce qui correspond à pKe = - log(Ke) = 14
Le produit ionique est donc également sans unité. Ke ne dépend pas des espèces chimiques en solution
aqueuse mais, comme les autres constantes d’acidité, de la température. Voir : calcul de Ke.
Exploitation du produit ionique de l’eau Ke : relation entre [H3O+]eq et [HO-]eq
Dans toute solution aqueuse, on pourra utiliser le produit ionique de l'eau pour relier [H3O+]éq et [HO-]éq
En effet, lorsque le pH d’une solution aqueuse sera différent de 7, les concentrations en ions oxonium et
hydroxyde seront différentes de 10 - 7 mol.L-1 mais leur produit reste égal à 10 - 14 (à 25 °C).
Ainsi, connaissant [H3O+]éq (par une mesure de pH par exemple), il sera facile d’en déduire [HO-]éq par la
relation [HO-]éq = 10-14 / [H3O+]éq ce qui reviendrait à utiliser [HO-]eq = 10(pH - pKe)
Ex : Si pH = 3, alors [H3O+]éq = 10-3 mol.L-1 et [HO-]éq = 10-11 mol.L-1
3- Réactions ACIDO - BASIQUES : DOSAGES (titrages)
3- 1 Constante d’équilibre : K d’une réaction acido - basique
Soient deux couples acide base A1 / B1 et A2 / B2 , de constante d'acidité respective KA1 , KA2.
Lors du mélange entre une solution d'acide A1 et de base B2
une réaction se produit : A1aq + B2aq = A2aq + B1aq
La constante d'équilibre K de cette réaction est :
3- 2 Dosages acido - basiques
Objectif d’un titrage
Un dosage est réalisé pour répondre à la question « combien ? ». Un titrage consiste à déterminer la
concentration (donc la quantité : n = C V ) d’un acide ou d’une base en solution.
Caractéristiques (critères) d’une réaction de dosage
Une réaction de dosage doit être spécifique, instantanée (très rapide) et totale (taux d'avancement τ peu
différent de 1, constante d'équilibre K > 103 ). De plus, il faudra détecter l’équivalence ( le Véq ).

Guibal Bellevue TS ch : 2. La transformation d’un système chimique est-elle toujours totale ? 5/5
Qu’est-ce que l’équivalence ?
L’équivalence est atteinte lorsqu’on a jouté juste assez de réactif titrant (généralement mis dans la burette)
pour obtenir un mélange stœchiométrique. À l'équivalence, les réactifs ont entièrement
réagit. L’équivalence correspond donc à un changement de la nature du réactif limitant.
Prenons l’exemple du titrage d’un acide A1 par une base B2 qui s’écrit : a.A1 + b.B2 = c.B1 + d.A2
À l'équivalence, la relation entre les quantités de matière est :
Il suffit ensuite d’exprimer n(A1) en fonction de CA et de VA etc..
Détermination du volume équivalent : Véq
Méthode 1: Utilisation d’un indicateur coloré
1) Utiliser un indicateur coloré dont la zone de virage contient le pH à l'équivalence.
2) Verser la solution titrante. Quand la solution à doser change de couleur on se trouve à l'équivalence.
3) Relever le volume de solution titrante.
Méthode 2: Méthode dite « des tangentes »
animation : "méthode des tangentes"
Titrage pHmétrique : On effectue
le dosage d'un acide par une base
(voir le dispositif : schéma). On
relève, pour différentes valeurs de
volume de base versée, le pH de la
solution puis on trace pH = f(Vb).
1) Tracer 2 tangentes à la courbe,
parallèles entre elles, de part et
d'autre du point d'équivalence.
2) Tracer la parallèle équidistante de
ces deux tangentes.
3) L'intersection de cette parallèle
avec la courbe pH = f ( Vb )
donne le point d'équivalence
E ( VbE ; pHE ).
Méthode 3: exploitation de la dérivée
(dpH/dVréactif titrant)
Lors du dosage d'un acide par une base, l'équivalence
est le point de la courbe pH = f(Vb) où la pente de la
tangente est maximale : Vb(versé) = VbE alors
dpH / dVb est maximum:
1) Tracer la courbe pH = f(Vb)
2) Calculer avec un logiciel la dérivée f ’(Vb)=(dpH/dVb)
3) En déduire graphiquement VbE. La valeur de VbE
correspond à la valeur maximale de la dérivée du pH par rapport au
volume de base versée (dpH/dVb)max.
Autre cas : Dosage d'une solution de base par un acide
Lors du dosage d'une base par un acide, le pH diminue. À l'équivalence,
le pH chute. Le volume équivalent est donné par le point équivalent E.
En ce point la pente de la tangente à la courbe est minimale (car
négative). Graphiquement Va(versé)éq correspond à dpH/dVa minimum.
1
/
5
100%