3 - AMPCfusion

UE11-Parcours – Immunologie
Cours 3
14/10/15
Pr B.CANQUE
RT : Louise Branchereau
RL : Laura Spurrier
Développement des lymphocytes T
I- Introduction
A- Fonctions du système immunitaire
B- Structure dichotomique du système immunitaire
C- Bases cellulaires de l’immunité
D- Théories de l’immunité
II- Fonction immunologique du thymus
A- Travaux de R.Good et J-F.Miller
B- Phénomène de coopération cellulaire
C- Restriction génétique du système immunitaire
D- CMH
III- Le développement thymique des LTs et TCRs
A- TCR
B- Développement thymique
C- Subdivision fonctionnelle des LTs
IV- Relation LT- cellule immunitaire
A-Régulation des LT
B- Relation LT-CPA et LB
Abréviations :
LT = Lymphocyte T
LB = Lymphocyte B
CPA = Cellule Présentatrice d’Antigène
TCR = T-Cell Receptor
NK = Natural Killer
ILC = Cellule Lymphoïde Innée
HLA = Human Leukocyte Antigen
GR = Globule Rouge
AC = Anticorps
Ag = Antigène

I- Introduction
A- Fonctions du système immunitaire
Détecter les pathogènes et/ ou les cellules anormales (exprimant des marqueurs de stress) :
Cela passe par une surveillance du milieu intérieur et des interfaces avec le monde extérieur. L’idée est
de combattre la diffusion des pathogènes et la prolifération anormale des cellules transformées. Pour
cela, il faut des effecteurs locaux. Il existe différentes vagues d’effecteurs :
- peu spécifiques mais rapides : effectuers de l’immunité innée
- spécifiques mais plus lents : les lymphocytes (ils reconnaissent un récepteur qui est limité
à la cellule ; constituent le bras cellulaire de l’immunité adaptative, l’autre bras étant
humoral avec les LB et la production d’AC).
Répondre de façon rapide et adaptée aux agressions :
Réponse insuffisante : la diffusion du pathogène continue et il n’y a pas de lésion tissulaire
Réponse adaptée : contenir la diffusion du pathogène, avec lésion tissulaire limitée.
Réponse excessive : élimination du pathogène au prix d’une lésion tissulaire énorme.
Exemple : lèpre tuberculoïde : pas beaucoup de bactérie, réponse immune très puissante => destruction
tissulaire massive
Capacité d’apprentissage et donc de mémoire
Base des vaccins.
Sans réponse immune adaptative, sans LT et LB, on ne pourrait pas vacciner.
B- Structure dichotomique du système immunitaire
Système immunitaire inné :
Réponse rapide, peu spécifique, action locale, réponse fixe et répétitive, mise en jeu dans toutes les
cellules de l’organisme.
La réponse immunitaire innée est double car :
o Toutes les cellules de l’organisme présentent une capacité de défense qui leur est
propre, donc même une cellule non leucocytaire peut se défendre contre les
pathogènes (notamment viraux).
o L’immunité innée est également médiée par les leucocytes.
Système immunitaire adaptatif :
Réponse retardée, hautement spécifique, action locale et générale, cellules mémoires (évolution
dynamique), réponse immunitaire médiée par les lymphocytes (erreur sur la diapositive).
C- Bases cellulaires de l’immunité
Il existe deux lignages : le lignage myéloïde (dédiée au système immunitaire inné pour les grands traits)
et le lignage lymphoïde.
Lignage Myéloïde
o Système immunitaire inné : Monocytes/macrophages, les polynucléaires (qui sont en
réalité des mononuclées dont le noyau est polylobé).
o Les polynucléaires sont à l’origine du pu, ce sont des effecteurs à durée de vie
extrêmement courte qui vont combattre localement les pathogènes et qui vont exploser
au contact des pathogènes. Ils produisent des radicaux oxygénés libres qui vont agresser
les pathogènes de manière directe, et peuvent également relarguer leur ADN pour

former des tissus qui vont emprisonner les bactéries et permettre aux autres cellules de
venir les détruire.Les cellules dendritiques
Elles ne sont pas effectrices directes, elles assurent le transfert d’information entre
l’immunité innée et adaptative. Ce sont des CPA qui vont stimuler les LT.
Lignage lymphoïde
4 types : Les LT, les LB, les NK, les ILC (cellules lymphoïdes innées).
Ces cellules sont plus petites, plus monotones, beaucoup plus diversifiées au niveau phénotypique par
rapport à la lignée myéloïde.
D- Les théories de l’immunité
1- Théorie Immunité humorale
Paul Ehrlich : immunologiste dont le champ de réflexion s’étendant à la biologie en général.
Il est à l’origine de la théorie humorale.
Concept Ag/Ac : il a fondé le corpus théorique de l’immunité adaptative dont la théorie des
chaînes latérales
Sérothérapie : a beaucoup travaillé sur le tétanos, le botulisme et la diphtérie (Maladies
bactériennes liées à la production d’une toxine) ce qui lui a permis de découvrir le support de
l’immunité antitoxique est soluble (transferable) et spécifique. Il a posé les bases de la
sérothérapie : le transfert de sérum malade qui a guéri vers le sérum de quelqu’un qui a été en
contact avec le pathogène ou qui commence la maladie.
Concept de récepteur : il a été le premier à réfléchir en terme moléculaire
Concept de toxoïd : une toxine est une substance chimique acellulaire. Substance dénaturée
qui n’est plus pathogène mais qui est encore immunogène. Il conceptualise ça en disant que
chimiquement la structure toxique est tridimensionnelle, et est indépendante de la structure
soluble qu’on trouve dans le sérum, spécifique au récepteur : l’épitope.
Il figure la notion de spécificité par ce qu’il appelle le protoplasme qui correspond à des
prolongements cellulaires qui reconnaissent les structures.
Karl Landsteiner :
Découvre les groupes sanguins, première preuve des polymorphismes humains.
Concept de répertoire
Un répertoire immunologique c’est l’ensemble des déterminants moléculaires que va
reconnaître un effecteur cellulaire ou moléculaire. On a un répertoire AC = ensemble des
déterminants chimiques présents dans le monde extérieur reconnus par les AC. Il postule que
le répertoire anticorps est infini : les LB peuvent produire au moins un AC capable de
reconnaître tous les déterminants auxquels nous sommes exposés.
Concept de Hapten-Carrier :
Hapten : plus petite structure chimique pouvant être reconnue par un anticorps
Carrier : autre structure chimique, portée par la même molécule mais reconnue par un
LT.
Les travaux de Porter et Edelman vont ensuite définir la structure des AC : un hétérodimère composé
de deux chaines lourdes et deux chaines légères. C’est la partie variable qui permet de reconnaître la
cible et l’AC est bivalent : reconnait deux molécules cibles. On a donc cette structure en Y avec la
base, partie constante qui porte les fonctions effectrices des AC et les deux têtes porteuses de la
spécificité de la reconnaissance.
La biochimie a précédé la biologie en immunologie : on a d’abord caractériser les Ac avant de savoir
quelles cellules les produisaient car on ne savait pas cultiver des cellules in vitro.

Le modèle aviaire (poulet) fut le premier modèle d’étude fonctionnelle du système immunitaire,
avec la découverte du lieu de production des Lb chez le poulet : la bourse de Fabricius (découverte
par l’anatomiste du même nom). C’est ensuite une découverte hasardeuse : Glick par des
bursectomies cherchait la fonction de la bourse sans résultat. Il confie ensuite ses poulets
bursectomisés à Chang, étudiant qui cherchait à développer des AC et se rend ainsi compte que sans
cette bourse, il ne peut y avoir production d’AC. Chez l’homme, la bourse de Frabricius n’existe pas,
les LB sont produits dans la moelle osseuse.
2- Théorie corpusculaire
Ce sont des effecteurs cellulaires directs (pas de production d’effecteurs solubles que sont les AC).
Immunité innée : Metchnikoff
Découverte de la phagocytose : en injectant des bactéries, il regarde arriver les polynucléaires
Invente la pathologie comparée : développe des études de maladies infectieuses en observant
la diffusion du pathogène
Hypersensibilité retardée : les lymphocytes
Murphy a montré que le rejet de greffe n’est pas médié par les Ac mais par une infiltration
massive de petites cellules (les LT) au sein du greffon qui vont le détruire : réponse immune
spécifique indépendante de la production d’effecteurs solubles.
Etat de l’art :
Il existe deux types d’immunité :
Humorale :
o Médiée par des effecteurs solubles (AC) -> transférable par le sérum
o A la base de l’immunité anti-toxinique
Cellulaire :
o Supportée par de petits lymphocytes
o Impliquée dans le rejet de greffe et la réponse anti-tumorale
o Transferable par des cellules (de rate/moelle osseuse)
Dans les deux cas, on a un caractère de spécificité.
II- Fonction Immunologique du Thymus
On a commencé à comprendre le fonctionnement des LT avec la découverte du thymus.
A- Travaux de Robert Good et J.F Miller
Thymectomie chez la souris en néonatal=> souris malades avec défaut de croissance : Les souris sont
immunodéficientes.
Expérience 1 (basée sur les travaux de Gross) :
Utilisation d’un virus leucémogène (provoquant des leucémies) injecté à
des souris thymectomisées.
Dans un cas, les souris subissent une greffe de thymus après injection.
On observe que chez les thymectomisées non greffées, il n’y a pas de
leucémie, alors que chez les thymectomisées greffées, tous les sujets sont
atteints de leucémie.
Le thymus a donc une fonction spécifique, car si on enlève le thymus, le virus n’est plus
pathogène (tropisme thymique).

Expérience 2 :
Irradiations de souris, thymectomisées ou non. On leur fait subir une greffe de moelle.
Les souris irradiées greffées vont garder un système immunitaire normal alors que les souris irradiées
non greffées vont rester immunodéficientes.
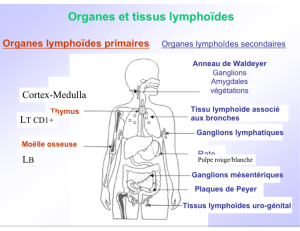
La bourse de Fabricius (LB pour Boursa de bourse de Fabricius) et le Thymus (LT) sont des organes
lymphoïdes primaires. Ils produisent des lymphocytes mais ne sont pas le siège d’une réponse type.
B- Phénomènes de coopération cellulaire (découverte de l’activité
auxiliaire)
Max Cooper, à partir du modèle aviaire, a pu construire des animaux dépourvus en LT ou LB.
Expérience :
Max Cooper va thymectomiser des poulets et étudier leur production d’anticorps après vaccination et
le rejet après greffe de thymus.
Lorsqu’il fait une thymectomie, et qu’il fait une greffe, il n’y a plus de rejet de greffe. Le LT aurait
donc un rôle dans le rejet de greffe.
Lorsqu’il vaccine les poulets thymectomisés, il remarque un défaut de production d’Ac. Les Lb sont
donc moins efficaces dans la production d’Ac. -> Coopération entre les LT et LB.
Les LT ont donc une double fonction : une action directe (sur le rejet de greffe pour détruire
leur cible), et une action indirecte (auxiliaire/helper des LB pour stimuler la production d’AC).
Pour avoir une bonne réponse anticorps, il faut une double reconnaissance : une reconnaissance
épitopique par l’AC lui-même, mais également sur la même cible, un site de reconnaissance : structure
reconnue par les LT. Il faut donc deux déterminants qui fonctionnent de façon synergique pour induire
une réponse.
L’activité T auxiliaire regroupe l’ensemble des mécanismes par lesquels les LT interagissent et
coopèrent avec les LB afin d’induire une production optimale d’anticorps, en terme qualitatif
(spécificité) et quantitatif.
C- Restriction génétique de la réponse immunitaire (découverte du
CMH)
On travaille sur la souris car elle tolère la consanguinité, ce qui signifie que l’on peut avoir une lignée
congénique. On peut supposer que le différentiel observé est introduit par le schéma expérimental et
non par le background génétique.
Définition de la restriction génétique : Pour répondre à un Ag, un LT doit être stimulé par une
cellule autologue, c’est à dire syngénique.
La réponse T est génétiquement restreinte, la réponse B ne l’est pas.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%