Etude des protéines Les protéines sont des macromolécules de la

Etude des protéines
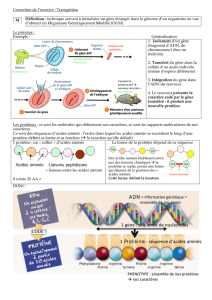
Les protéines sont des macromolécules de la cellule, dont elles constituent la « boîte à outils », lui permettant
de digérer sa nourriture, produire son énergie, de fabriquer ses constituants, de se déplacer, etc. Elles se
composent d'un enchaînement d'acides aminés (parmi 20 possibles) liés par des liaisons peptidiques. Cet
enchaînement possède une organisation tridimensionnelle (ou repliement) qui lui est propre. De la séquence au
repliement, il existe 4 niveaux de structuration de la protéine :
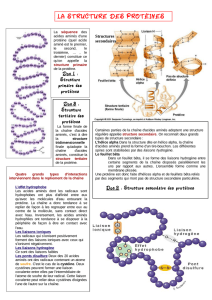
La structure primaire, ou séquence, d'une protéine correspond à la succession
linéaire des acides aminés (ou résidus) la constituant sans référence à une
configuration spatiale. Les protéines sont donc des polymères d'acides aminés,
reliés entre eux par des liaisons peptidiques
La structure secondaire décrit le repliement local de la chaîne principale d'une
protéine. Il existe trois principales catégories de structures secondaires selon
l'échafaudage de liaisons hydrogènes, et donc selon le repliement des liaisons
peptidiques : les hélices, les feuillets et les coudes.
La structure tertiaire d'une protéine correspond au repliement de la chaîne
polypeptidique dans l'espace. On parle plus couramment de structure
tridimensionnelle, ou structure 3D. Lorsque cette structure est cassée par
l'emploi d'agent dénaturant, la protéine est dénaturée.
La structure quaternaire des protéines regroupe l'association d'au moins deux
chaînes polypeptidiques - identiques ou différentes - par des liaisons non-
covalentes, liaisons dîtes faibles
Fabrication d’une protéine : l’insuline
L'insuline mature comporte 51 acides aminés répartis sur les deux chaînes :
- chaîne A (21 acides aminés) :
Gly- Ile- Val- Glu- Gln- Cys- Cys- Thr- Ser- Ile- Cys- Ser- Leu- Tyr- Gln- Leu- Glu- Asn-
Tyr- Cys- Asn
- chaîne B (30 acides aminés) :
Phe- Val- Asn- Gln- His- Leu- Cys- Gly- Ser- His- Leu- Val- Glu- Ala- Leu- Tyr- Leu- Val-
Cys- Gly- Glu- Arg- Gly- Phe- Phe- Tyr- Thr- Pro- Lys- Thr
Fabriquez la structure primaire de chacune de ces 2 chaines
Il faut noter la présence de 3 ponts disulfures (liaisons entre deux souffres de cystéines non voisines), deux
liaisons hydrogène (entre valine et Glutamine de la chaine A et entre la sérine et la lysine de la chaine B).
Réalisez la structure secondaire de ces deux chaines à l’aide de la patafix.
Enfin, vous pouvez faire la structure tertiaires en accolant l’une à coté de l’autre les deux chaine créées.
Précisez ce qui se passerait dans les cas suivant :
Une mutation provoque le remplacement de la seconde cystéine de la chaine A par l’acide aminé
proline.
Un pH trop acide détruit les liaisons hydrogène

Lien Forme/fonction chez les protéines
La ribonucléase est une enzyme du pancréas qui participe activement à la digestion. Elle est constituée de 124
acides aminés. La chaîne d'acides aminés possède en 4 endroits des liaisons entre des acides aminés appelés
cystéines (figure A).
Le biochimiste Anfinsen a réalisé différents travaux sur cette protéine. En la traitant par de l'Urée, puis par le
mercaptoéthanol, la molécule prend l'aspect de la figure B.
Si on élimine le mercaptoéthanol et qu'il reste de l'urée dans le milieu, la molécule figurée en B se transforme et
prend l'aspect de celle figurée en C.
L'activité enzymatique existe naturellement pour la forme A, elle est nulle pour la forme B et très faible pour la
forme C.
On précise que la représentation ci-dessus ne fait apparaitre que les acides aminés intervenant dans la structure
tertiaire de cette protéine. Comme pour toute autre protéine, le long fil correspond à une succession d’acides-
aminés.
Saisir des informations : Quelle est la principale cause de repliement de la chaîne d’acides-aminés ?
Analyser des résultats : Rechercher une explication à la perte de l'activité enzymatique de la forme B et à la
faible activité de la forme C de la molécule.
Emettre une hypothèse : Si à la suite d'une modification, il y avait disparition de l'acide-aminé 84 et 72, quelle
pourrait être la conséquence pour la protéine ? et pour l’individu la possédant ?
1
/
2
100%