c4-activite-2-enantiomeres

Stéréochimie des molécules Page 1
TS - C4 - Activité 1 : Chiralité et énantiomérie
1. « Le monde de la chiralité »
« Celui qui n’éclate pas de rire, lorsqu’il se penche pour regarder ses pieds nus, celui-là n’a soit aucun sens de
l’humour, soit aucun sens de la symétrie. »
C’est par cette phrase humoristique que le mathématicien et philosophe Descartes (1596- 1650) exprima le
premier, sans le nommer, le phénomène de chiralité. Mais qu’entend-on par chiralité ?
Les chimistes du XXIe siècle observèrent que des structures moléculaires identiques, c'est-à-dire possédant les
mêmes enchaînements atomiques, pouvaient se différencier par le fait qu’elles n’étaient pas superposables,
l’une étant image de l’autre dans un miroir. Le physicien Lord Kelvin (1824-1907) donna, en 1898, un nom à
cette propriété : il l’appela « chiralité ». Ce mot vient du grec « Kheir » qui signifie la main. Qui n’a jamais
remarqué, en effet, que les deux mains d’un individu sont images l’une de l’autre dans un miroir ?
Cette notion de chiralité conduit directement aux notions de « gauche » et de « droite », notions
omniprésentes dans notre vie quotidienne. Nous vivons, en effet, dans une société conçue et réalisée presque
exclusivement pour les droitiers. Ainsi, le pas de vis et le tire-bouchon tournent à droite de telle façon qu’ils
s’enfoncent d’un geste naturel de la main droite. Il en est de même pour les casseroles avec un bec verseur :
elles sont construites pour les droitiers. Pourquoi les gauchers ont-ils des difficultés à se servir de ces objets ?
Parce que, comme dans le cas des mains, il s’agit de systèmes chiraux. […]
Chacun pressent la notion de symétrie cachée derrière ce terme de chiralité, mais rappelons nous d’abord la
définition simple qu’en a donnée le mathématicien Weyl (1885-1955) : un objet est symétrique si, après avoir été
soumis à une certaine action, son apparence n’est pas modifiée. L’action la plus simple de toutes est le
déplacement dans l’espace. On peut ainsi, sans en modifier l‘apparence, déplacer une sphère, un cube ; l’objet
et l’image coïncident par une simple translation. Par contre, on ne peut pas faire coïncider la main droite et la
main gauche par un simple déplacement dans l’espace. C’est donc une autre opération de symétrie qui
intervient dans le phénomène de chiralité : la réflexion dans un miroir plan. L’image virtuelle d’une main droite
est une main gauche. Les deux mains sont symétriques par rapport au miroir plan.
Par exemple, le mot TARD se lit de gauche à droite mais son image dans un miroir se lit de droite à gauche.
Pour le palindrome TÔT, le problème du sens de lecture ne se pose pas. Mais là ne s’arrête pas les différences.
Les lettres constituant le mot présentent entre elles également des différences. En effet, si A et T sont identiques
à leur image dans un miroir, R et D se transforment en .... et .... Mais par une simple rotation dans le plan ... peut
redonner D. Par contre, aucun mouvement de rotation ou de translation plane de …. ne permet de retrouver la
lettre R. La lettre R est donc un objet chiral. On dit alors que R /... est un couple d’énantiomères (1). […]
(1) Enantiomères : se dit de deux objets images l’un de l’autre dans un miroir et non superposables
Jeux : http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2001/illpres/game.html
2. Pasteur et la chiralité
Pour les chimistes, Pasteur est en premier lieu considéré comme l’un des pères de la stéréochimie, domaine de
la chimie moderne basé sur l’arrangement en trois dimensions des molécules. En séparant manuellement les
deux sortes de cristaux d’acides tartriques, Pasteur découvre la dissymétrie moléculaire. Le seul acide tartrique
qu’on connaissait à l’époque était un sous-produit classique de la vinification, utilisé dans la teinturerie. Il établit
que la dissymétrie de la forme cristalline correspond à une dissymétrie interne de la molécule et montre la
relation entre la constitution des cristaux et l’orientation de la lumière polarisée. La notion de chiralité apparaît
par la mise en évidence qu’une molécule peut exister sous deux formes dissymétriques inverses l’une de l’autre.
Extrait du concours « Saga de la chimie moderne » (AIC 2011), ENSCR Rennes
Sur les traces de Pasteur : http://www.nathan.fr/upload/doccpg/172376_C14_anim_pasteur.swf

Stéréochimie des molécules Page 2
3. Un exemple d’objet chiral
Chacune des coquilles d’escargots représentées ci-contre est chiral :
Questions
1) Compléter les pointillés dans la partie 1 du texte page 1.
2) Proposer une définition pour le mot chiralité.
3) Donner trois exemples d’objets chiraux et d’objets non chiraux de la vie de tous les jours.
Faire un dessin en vous aidant d’un miroir plan pour mettre en évidence la chiralité dans ces objets.
4) Expliquer ce que sont deux énantiomères.
5) D’après l’expérience de Pasteur, quelle propriété permet de distinguer deux énantiomères ?
6) Un mélange équimolaire d’énantiomères est appelé mélange racémique. Ce mélange sera-t-il optiquement actif ?
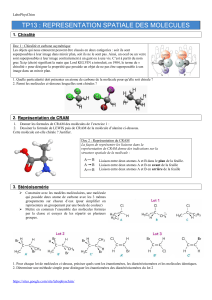
4. Chiralité et représentation des molécules
Une molécule chirale est souvent représentée selon la convention de Cram. Cette représentation de
la molécule dans l’espace fait apparaître les liaisons en perspective.
Questions
7) Parmi les trois molécules ci-dessous, deux sont image l’une de l’autre dans un miroir. Lesquelles ? Sont-elles
superposables l’une avec l’autre ?
8) Parmi les molécules ci-dessous en représentation de CRAM, trois présentent le phénomène de chiralité (on
dit qu’elles sont chirales). Lesquelles ?
OH
C2H5CH3
H
COOH
NH2H
H
COOH
NH2CH3
H
OH
CH3Cl
H
9) En observant les molécules précédentes, trouver une condition portant sur l’un des atomes de carbone de la
molécule, appelé atome de carbone asymétrique pour qu’une molécule soit chirale.
10) La molécule d’acide tartrique, sur laquelle Pasteur a mis en évidence la chiralité, a pour formule semi-
développée HOOC-CHOH-CHOH-COOH. Pourquoi cette molécule est-elle chirale ? Représenter les deux
énantiomères en utilisant la représentation de CRAM pour les carbones asymétriques.
O
O
O
O
O
O
O
N
C
V
C
C
C
C
C
C
N
C
V

Stéréochimie des molécules Page 3
5. Les acides aminés
Les acides aminés sont des molécules qui entrent dans la composition des protéines grâce à leur assemblage
par des liaisons que l'on appelle peptidiques.
Leur nom provient du fait qu'ils possèdent une fonction amine (NH2) et une fonction acide carboxylique (COOH).
Ils se distinguent par leur chaîne latérale, R, qui peut être un simple atome d'hydrogène (c'est la glycine), ou
bien être plus complexe.
Les acides α-aminés se définissent par le fait que leur groupe amine est lié à l'atome de carbone adjacent au
groupe acide carboxylique (le carbone α)
Il existe une centaine d'acides aminés, mais seuls 22 sont codés par le génome des organismes vivants.
Chaque acide aminé confère à la protéine des propriétés chimiques spécifiques, et l'ordre d'assemblage lui
donne une fonction bien précise.
Parmi eux, 19 acides aminés ne contiennent que quatre éléments chimiques : le carbone, l'hydrogène, l'oxygène
et l'azote ; deux acides aminés contiennent en plus un atome de soufre (cystéine et méthionine), et un acide
aminé assez rare contient un atome de sélénium.
Structure générique des acides -aminés
D’après sites Internet futura science et Wikipedia
Questions
11) Quelles sont les fonctions présentes dans les molécules d’acides aminés ? Représenter la formule semi-
développée de la molécule de leucine et entourer ces fonctions.
12) Parmi les acides -aminés, un seul n’est pas chiral. Lequel ? Pourquoi tous les autres acides -aminés sont-
ils chiraux ?
13) En utilisant la représentation de Cram, dessiner les deux énantiomères de l’alanine.
14) La réaction de formation d’une liaison entre deux acides -aminés
conduit à un dipeptide.
a) Comment se nomme cette liaison ?
b) Combien d’atome(s) de carbone asymétrique(s) comporte ce dipeptide ?
Le(s) repérer par un astérisque.
c) Comment se nomme le groupe caractéristique ainsi formé ?

Stéréochimie des molécules Page 4
6. Propriétés biologiques des énantiomères
Au XIXe siècle, on utilisait déjà des principes actifs chiraux comme la morphine, administrée comme anti-douleur
et extraite du pavot ou la quinine, prescrite comme anti-paludique et extraite des écorces de quinquina. La
structure chimique et tridimensionnelle de ces molécules n'était cependant pas connue. Malgré les idées
énoncées par Pasteur à la fin du XIXe, les chimistes ont mis beaucoup de temps pour comprendre que la
chiralité pouvait avoir un impact considérable sur les organismes vivants. Cette prise de conscience a eu lieu
dans les années 1960 avec le drame de la thalidomide, médicament qui fut administré aux femmes enceintes
comme anti-vomitif, et qui provoqua chez les nouveaux-nés de graves malformations. On connaît aujourd'hui la
raison de ce drame : alors qu’un des énantiomères est bien anti-vomitif, l’autre est tératogène !
Beaucoup de médicaments possèdent des propriétés thérapeutiques différentes selon leur forme énantiomère.
Le naproxène ou l'ibuprofène sont connus pour avoir un effet anti-inflammatoire et antipyrétique sous une forme
et sans effet important sous l’autre forme. L'administration du composé sous mélange racémique est peu
intéressante car le patient ingère 50% de substance dont il ne tire aucun bénéfice mais qui au contraire possède
généralement des effets secondaires. Ils sont donc administrés sous forme énantiopure.
Les goûts et les odeurs ont également un rapport avec la chiralité. L'asparagine a le goût amer caractéristique
de l'asperge sous une forme d’énantiomère et possède un goût plutôt sucré sous l’autre forme. Le limonène
(composé issu du citron) a effectivement une odeur de citron sous une forme, mais plutôt une odeur d'orange
sous l’autre.
LA CETIRIZINE
La cétirizine est un antihistaminique utilisé dans le traitement de l'allergie.
La cétrizine est une molécule chirale ; seule la lévocétirizine a un intérêt thérapeutique.
L’IBUPROFENE
L’ibuprofène possède un seul carbone asymétrique et peut dès lors exister sous forme de
deux énantiomères. Le produit commercial est généralement le mélange racémique.
Cependant, seul un des énantiomères est biologiquement actif et présente les effets
thérapeutiques désirés.
L’énantiomère R est très difficile à séparer du S, mais est heureusement inoffensif.
L’énantiomère S seul commence à produire son effet après 12 minutes, alors que le
mélange racémique n’est actif qu’après 38 min.
Très curieusement, le corps humain possède par chance la propriété de pouvoir
transformer chimiquement l’énantiomère R inactif en énantiomère S.
Mécanisme de reconnaissance moléculaire et isomérie :
Les mécanismes de reconnaissance entre molécules biologiques (enzyme-substrat, médicament-protéine
cible…) se font selon le mode « clé-serrure », assurant la reconnaissance par un seul des deux énantiomères.
15) Proposer une définition des termes mélange racémique et forme énantiopure.
16) Les récepteurs olfactifs de l'homme sont-ils sensibles à la chiralité des molécules ? Justifier.
17) En vous appuyant sur le document ci-dessus, expliquer pourquoi deux énantiomères ont de propriétés
biologiques différentes. Quel est le danger pour l’homme ?
1
/
4
100%