FR_542_02 (500 Ko) - INAC

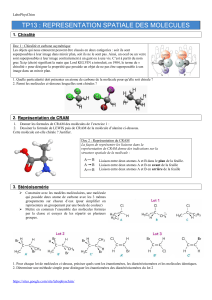
Comité de rédaction : E. Molva, J. Planès (DIR), P. Dalmas de Réotier (SPSMS), Th. Douki (SCIB),
G. Prenat (SPINTEC), S. Lyonnard (SPrAM), R. Vallcorba (SBT), P. Warin (SP2M) - Mise en page : M. Benini (DIR) tél. 04 38 78 36 33
Pour être compatibles avec les dispositifs de
la microélectronique, les composés destinés aux
mémoires moléculaires doivent pouvoir accep-
ter ou donner des électrons. De plus, ils ne
doivent pas retourner à leur état initial lorsque
le champ électrique est coupé. Ces conditions
nous ont amené à travailler avec des porphyrines
(Fig. 1) capables de changer de forme en fonction
de l’ion qu’elles complexent. En particulier, nous
cherchons parmi ces composés ceux qui sont
dits «bistables» c’est-à-dire qui, en changeant
de forme, stabilisent le même élément chimique
mais à des degrés d’oxydation différents. Cette
étude nous amène donc à la construction d’une
grande variété d’architectures moléculaires pour
en étudier la géométrie.
Nos molécules possèdent 4 substi-
tuants qui sont liés d’un côté à la por-
phyrine et de l’autre aux brides et qui
possèdent de ce fait une asymétrie, ou
chiralité (voir encart). On veut contrôler
la structure de la porphyrine finale et
éviter une combinaison aléatoire des
différents énantiomères des substituants
(4
R
, 2
R
et 2
S
, 3
R
et 1
S
, etc.). Il faut donc par-
tir de substituants sous une seule forme. C’était
bien le cas du biocartol commercial qui nous
a servi jusqu’à maintenant. Malheureusement,
l’industrie ne produit qu’un des 2 énantiomères,
ce qui ne nous permet pas de varier les structures.
Nous nous sommes donc attelés à la synthèse
d’une nouvelle famille de porphyrines portant des
substituants cycliques hydroxylés, pour lesquels
nous savons fabriquer les deux énantiomères.
Bras dessus, bras dessous
Cette synthèse se déroule en six étapes. Pour
sélectionner un énantiomère ou l’autre, nous
avons fait appel à une protéine capable de
modifier spécifiquement une des deux formes,
à la place du chimiste, et à plus à faible coût. Il
devient ainsi possible de « trier » les molécules
selon leur chiralité, et ceci assez rapidement,
même pour des quantités importantes de matière
(plusieurs grammes). Les premiers résultats ont
montré que cette nouvelle famille s’organise dans
l’espace différemment de ses grandes sœurs (Fig.
2). Nous allons maintenant ajouter les ions métal-
liques et caractériser les propriétés électrochimi-
ques et la bistabilité des nouveaux complexes.
Avantage supplémentaire : cette nouvelle
famille possède une structure chimique facile à
modifier. Plus de versatilité, c’est davantage de
paramètres à explorer : taille des substituants,
longueur des brides. Caractériser tous ces com-
posés nous aidera à déterminer les facteurs
importants pour la bistabilité des complexes.
Notre maîtrise complète de la synthèse sera
également un atout important pour les étapes de
greffage sur le silicium et l’intégration dans les
circuits électroniques.
Feuille Rouge
La
Contact : Lionel Dubois - SCIB - [email protected]
électronique moléculaire
LES NOUVEAUX CYCLES DE LA MEMOIRE
Les chimistes du laboratoire RICC et les électroniciens du LETI s’associent pour la réalisation de mémoires hybrides molécules-silicium. Dans cette
technologie, ce sont des molécules organiques qui sont le support de l’information (encart). L’originalité de l’approche développée est l’utilisation
de complexes métalliques de porphyrine, des molécules cycliques que l’on retrouve par exemple associées au fer dans les globules rouges pour le
transport de l’oxygène. Nous venons de mettre au point la synthèse d’une nouvelle famille de ces composés qui ouvre des perspectives originales
en terme de géométrie en vue stabiliser différents états d’oxydation.
Mémoires moléculaires
hybrides
Elles sont constituées d’un nanofil
de silicium, sur lequel sont greffées des
molécules redox-actives. Une électrode
sert à créer un champ électrique perpen-
diculaire au nanofil. Lorsque le champ
électrique est suffisamment élevé, des
charges électriques transitent des molé-
cules vers le nanofil créant ainsi un état
« 1 », l’état « 0 » étant l’état initial. Pour
avoir un effet mémoire, il est néces-
saire que les charges restent piégées
sur les molécules même en l’absence
du champ.
Fig. 1 : Structure schématique d’un complexe
métallique de porphyrine. L’ion (M) est à l’intérieur
du cycle. Sur ce dernier sont attachés quatre subs-
tituants chiraux, par exemple le biocartol, ou nos
nouvelles molécules hydroxylées. Ces substituants
sont liés deux à deux par une bride destinée à
rigidifier la molécule et piloter les changements de
forme.
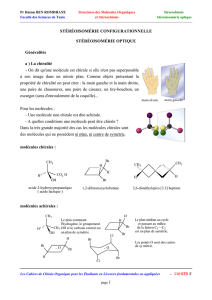
Chiralité
La chiralité d’une molécule se
définit par le fait que son image dans
un miroir ne lui est pas superposable.
Les deux molécules différentes (l’original
et son image) sont appelées énantiomè-
res. Deux énantiomères, dénommés
R
et
S
, ont exactement les mêmes proprié-
tés physico-chimiques (point de fusion,
d’ébullition …). On les distingue seu-
lement à ce qu’ils font tourner le plan
de polarisation de la lumière polarisée,
vers la gauche pour l’énantiomère
S
,
vers la droite pour l’énantiomère
R
. De
ces propriétés identiques des énantio-
mères vient la difficulté à les séparer.
Il faut pour cela utiliser d’autres objets
asymétriques (molécules, protéines, …)
qui reconnaissent plus facilement une
forme que l’autre.
Fig. 2 : Exemples de structures de complexes de
porphyrine. Dans le complexe du nickel des porphy-
rines du biocartol (Porph Biocart), les brides sont sur
le côté. Lorsque l’on remplace le nickel par du zinc,
elles passent d’un même côté du cycle. La nouvelle
porphyrine peut adopter une structure originale,
avec une bride de chaque côté du cycle.
FR_542.indd 2 10/04/2008 11:24:19
1
/
1
100%