Correction de la synthèse sur la stéréoisomérie.

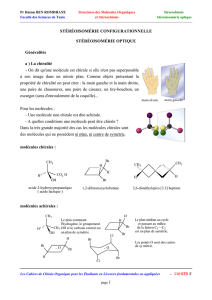
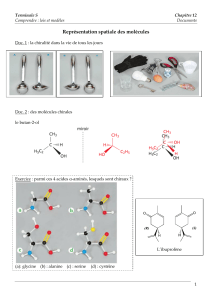
Il existe des molécules qui ont la même formule brute, une même formule semi-développée mais qui
diffèrent par la disposition dans l’espace de ses atomes. On parle de stéréoisomères. Parmi eux, on trouve
des molécules qui sont images l’une de l’autre dans un miroir. On parle d’énantiomères. Ces molécules ont
une structure spatiale qui leur est propre.
Ces molécules existent dans la nature et leurs propriétés ont été mises en évidence par Pasteur qui a réussi à
isoler les deux énantiomères de l’acide tartrique présent dans le raisin. Dans la nature, on trouve souvent les
deux énantiomères en quantités identiques. On dit que le mélange est racémique.
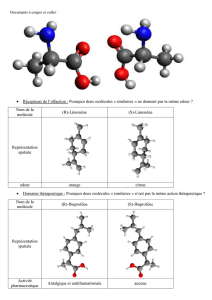
Par ailleurs, de nombreuses fonctions biologiques présentent des spécificités géométriques comme l’action
d’un enzyme, la perception d’un goût, l’action d’un médicament. Cet aspect a été modélisé en parlant du
fonctionnement « clé-serrure ».
Aussi, pour de nombreux médicament, la géométrie de la molécule active peut avoir un rôle essentiel et seul
un des énantiomères peut être actif, l’autre étant inactif au mieux ou dangereux au pire. C’est pour cette
raison qu’il est parfois nécessaire de séparer les énantiomères.
Dans le cas où l’énantiomère inactif n’est pas dangereux, il n’est pas nécessaire de séparer les énantiomères
mais il faut doubler la quantité de molécules actives puisque seul un énantiomère agit. Le mélange
racémique peut également retarder l’action du principe actif.
Cependant, on pourrait ne pas avoir à séparer les énantiomères si l’on ne synthétise que l’énantiomère actif
grâce à des synthèses énantiosélectives utilisant par exemple des catalyseurs chiraux.
Dans la plupart des cas, l’énantiomère inactif n’est pas dangereux, il n’est donc pas nécessaire de procéder à une
séparation systématique des énantiomères qui est longue et coûteuse mais on peut développer les méthodes de
synthèse énantioséléctives.
1
/
1
100%