Guide de révisions pour le DS n°2 - CPGE PCSI

1
Guide de révisions pour le DS n° 2
Ne sont mentionnés ici que les points nouveaux par rapport au guide de révisions pour le DS n°1.
ARCHITECTURE DE LA MATIERE
Chapitre II : Structure électronique des molécules
Mésomérie
Savoir que dans certains cas une structure de Lewis est insuffisante pour décrire la
structure électronique d’un édifice polyatomique ; savoir alors qu’on décrit l’espèce
comme un hybride de résonance entre différentes formes mésomères. Connaître les
notations et leur sens. Savoir qu’on parle de liaison délocalisée.
Savoir qu’entre deux formes mésomères les atomes et les électrons des liaisons simples
σ n’ont pas bougé ; seuls les électrons délocalisables, c’est-à-dire les électrons des
doublets non liants et des liaisons doubles ou triples (électrons π), peuvent se déplacer.
(Autrement dit : d’une forme mésomère à une autre on ne touche pas au squelette de la
molécule… bref, ne surtout pas confondre isomère et mésomère !)
Prendre l’habitude de vérifier systématiquement que la charge globale est bien
conservée d’une forme mésomère à une autre.
Connaître les termes : hybride de résonance, formes limites, conjugaison.
Savoir écrire et sélectionner les différentes formes mésomères importantes pour la
description d’une espèce, savoir comparer leurs poids ou degré de contribution.
Savoir que plus une espèce possède de formes mésomères, plus elle est stable.
Géométrie des molécules : méthode V.S.E.P.R.
Connaître le principe de la méthode V.S.E.P.R.
Connaître les cinq polyèdres de coordination (AX
n
E
0
) et en particulier les angles de ces
géométries régulières.
Connaître les géométries dérivées de chaque polyèdre. (AX
n
E
m
≠
0
)
Savoir appliquer la méthode et donner la géométrie autour de chaque atome de tout
édifice polyatomique.
Savoir comment sont modifiés les angles dans le cas d’une distribution dissymétrique
du type de liaison.
Connaître et savoir expliquer l’influence de l’électronégativité de l’atome central et des
atomes liés.
Moments dipolaires
Savoir définir le moment dipolaire µ d’une liaison, donner son sens, savoir l’exprimer
en fonction de la charge partielle et de la distance internucléaire.
Savoir ce qu’est le pourcentage ionique d’une liaison et savoir le calculer à partir de µ et
l.
Savoir que le moment dipolaire global d’une molécule est la somme vectorielle des
moments dipolaires de liaison et le calculer.
Savoir déterminer l’existence et l’orientation du moment dipolaire total d’une molécule,
en tenant compte d’éventuelles formes mésomères.

2
Effets électroniques
Savoir ce qu’est l’effet inductif, connaître ses caractéristique et ses conséquences. Savoir
identifier les groupes à effet inductif attracteur (-I) et donneur (+I). Savoir que les
groupes alkyles ont un effet global +I.
Connaître l’effet mésomère et ses conséquences. Savoir identifier si un groupe est
mésomère donneur +M ou mésomère attracteur –M.
Savoir que l’effet mésomère l’emporte généralement sur l’effet inductif et qu’il peut se
propager le long d’une chaîne tant qu’il y a des électrons conjugués.
CHIMIE ORGANIQUE
Connaître les différentes écritures des molécules organiques et en particulier maîtriser
l’écriture des formules topologiques.
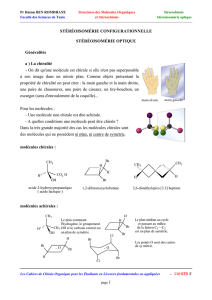
Modes de représentation spatiale des molécules.
Connaître et savoir manipuler la représentation de Cram, la projection de Newman et le
dessin en perspective d’une molécule.
Chapitre I : Nomenclature
Maîtriser le passage d’une formule développée ou semi-développée à la formule
topologique correspondante et inversement.
Savoir écrire rapidement la formule brute à partir de la formule topologique.
Savoir compter les insaturations dans une formule topologique.
Connaître la définition du nombre d’insaturations et la formule permettant de le
calculer à partir d’une formule brute.
Connaître le nom des grandes fonctions de la chimie organique et savoir reconnaître
leur structure caractéristique dans une molécule.
Savoir nommer des molécules de taille raisonnable conformément aux règles de
l’UICPA.
Connaître en particulier les suffixes associés aux fonctions alcool, aldéhyde, cétone,
acide carboxylique, et ester.
Savoir nommer un étheroxyde, une amine, un nitrile, un chlorure d’acyle, un nitrile ou
un anhydride d’acide simples.
Connaître les préfixes associés aux fonctions alcools, aldéhyde et cétone, amine.

3
Chapitre II : Analyse conformationnelle
Savoir que deux conformations diffèrent par des rotations autour de liaisons simples.
Savoir qu’un conformère est caractérisé par une conformation correspondant à un minimum
significatif d’énergie potentielle.
Savoir que des conformères ne peuvent être isolés à température ambiante, car l’énergie de
l’agitation thermique est du même ordre de grandeur que celle nécessaire pour effectuer des
rotations autour d’une liaison simple.
Savoir ce qu’est un angle dièdre.
Savoir construire les diagrammes énergétiques de l’éthane et du butane.
Savoir ce qu’est une gêne stérique, une interaction dans une conformation décalée gauche
(dite « butane gauche ») et 1,3-diaxiale.
Savoir représenter les deux conformations chaises du cyclohexane en positionnant
correctement tous les hydrogènes.
Savoir passer de la représentation « semi-plane » (cycle plan avec des substituants en
représentation de Cram) à la représentation en perspective et à la représentation de
Newman.
Comprendre que dans le cas d’un cyclohexane monosubstitué, il existe deux conformations
chaises, en équilibre l’une avec l’autre, et qu’elles n’ont pas la même énergie.
Savoir que celle qui possède le groupe en équatorial est la plus stable et pourquoi.
Connaître la nomenclature cis / trans des cycles disubstitués.
Savoir représenter toutes les chaises d’un cyclohexane disubstitué et identifier la plus stable.
Savoir reconnaître la présence ou non de carbones asymétriques, la chiralité ou l’achiralité de
la molécule, qui ne sont pas liées.
Chapitre II : Isomérie de constitution
Savoir définir les termes isomère et isomère de constitution.
Savoir définir et reconnaître des isomères de chaîne, de position ou de fonction.
Chapitre III : Stéréoisomérie
La stéréoisomérie de configuration.
Savoir définir les énantiomères et les diastéréoisomères et les reconnaître.
Savoir expliquer que, lorsque chacun des deux carbones d’une double liaison C=C porte
deux groupes différents, il existe deux diastéréoisomères.
Connaître le classement de Cahn, Ingold et Prelog (CIP), savoir l’appliquer dans n’importe
quel cas et donc savoir indiquer si un alcène est Z ou E.

4
Les notions suivantes sur la stéréoisomérie seront trop fraîches pour constituer une part
importante du DS, mais quelques petites questions ne sont pas à exclure :
Savoir définir « carbone asymétrique » et savoir reconnaître les carbones asymétriques d’une
molécule.
Comprendre qu’à une formule possédant un carbone asymétrique correspond deux
énantiomères.
Savoir déterminer la configuration absolue R ou S d’un carbone asymétrique.
Savoir ce que sont un mélange racémique et un composé énantiomériquement pur.
Connaître la définition de la chiralité, comprendre que deux énantiomères sont deux
molécules chirales.
Savoir identifier si une molécule est chirale ou achirale.
Savoir en particulier qu’une molécule possédant un plan ou un centre de symétrie est
achirale.
Savoir dénombrer, représenter et identifier les relations de stéréoisomérie de tous les
stéréoisomères de configuration des molécules avec 2 carbones asymétriques substitués,
différemment ou identiquement.
En particulier connaître le composé méso et savoir le reconnaître.
Connaître le principe des mesures polarimétriques et ce qu’est le pouvoir rotatoire d’un
échantillon.
Connaître les définitions d’un échantillon optiquement actif, lévogyre et dextrogyre.
Connaître la loi de Biot avec les unités usuelles.
Savoir que deux énantiomères ont des propriétés physiques rigoureusement identiques sauf
les pouvoirs rotatoires spécifiques, qui sont opposés ; alors que des diastéréoisomères ont
des propriétés physiques et chimiques différentes.
Savoir que deux énantiomères ont exactement les mêmes propriétés chimiques sauf vis-à-vis
d’un composé chiral (ce qui peut conduire en particulier à des propriétés biologiques
différentes).
Savoir qu’un mélange racémique est optiquement inactif et le comprendre.
Connaître le principe du dédoublement d’un racémique.
Bien distinguer la chiralité de l’activité optique, ce sont deux propriétés qui ne s’appliquent
pas au même objet : une molécule est chirale (propriété structurale), un échantillon est
optiquement actif (propriété expérimentale).
Travaux pratiques
Savoir expliquer comment on conduit une recristallisation, technique de purification
des solides.
Savoir ce qu’est un oxyde et savoir écrire une équation de combustion.
1
/
4
100%