PROGRAMME DE COLLE n°1

PROGRAMME DE COLLE n°3.
Semaine du 3/10 au 7/10/16
I-Architecture de la matière.
A- La classification périodique.
Rappels sur l’atome.
Structure électronique des atomes
La classification périodique des éléments
B- Structure électronique des molécules.
Notation de Lewis
Mésomérie
Géométrie des molécules : théorie de Gillespie, méthode V.S.E.P.R. :
principe général : type AXnEm, figure de base, géométrie de la molécule : terme descriptif,
dessin, angle valentiel.
déformations des géométries régulières : modification des angles
calcul du moment dipolaire total : molécules polaires ou apolaires
III-Chimie organique. A-STEREOCHIMIE.
Introduction : nomenclature*, écriture des molécules (formule brute (calcul du nombre
d’insaturations), semi-développée, topologique), les isoméries : de constitution (chaîne, fonction,
position) et stéréoisomérie (définitions de configuration et conformation).
*NB : pour la nomenclature, savoir nommer les alcanes, les halogénoalcanes, les alcènes, les amines, les
alcools, les éther-oxydes, les cétones-aldéhydes, les nitriles, les esters et les acides carboxyliques.
Modes de représentation des molécules : Cram, Newman et perspective.
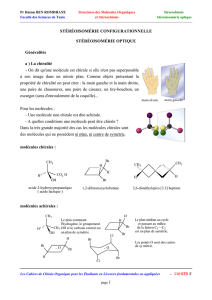
Stéréoisomérie de configuration :
un exemple de diastéréoisomères : alcènes Z et E
classement C.I.P Cahn Ingold et Prelog.
le carbone asymétrique, deux énantiomères, descripteur stéréochimique R ou S.
la chiralité : aspect structural, propriété des énantiomères, critère de symétrie pour l’achiralité
(plan et centre), l’axe de rotation n’est PAS un critère,
composés avec deux carbones asymétriques : différemment substitués (4 stéréoisomères : 2
couples d’énantiomères) ou identiquement substitués (3 stéréoisomères : 1 couple
d’énantiomères et un composé méso achiral).
B-SPECTROSCOPIES.
Spectroscopie d’absorption infrarouge : transitions vibrationnelles, vibration d’élongation ou de
déformation, loi de Hooke, influence de la liaison hydrogène sur la vibration de la liaison O-H des alcools
et des acides carboxyliques, influence de la conjugaison sur les liaisons doubles.
Vibrations d’élongation à connaître : C=C, C=O, O-H alcool et acide carboxylique, C-H alcane, alcène,
aromatiques et alcyne, aldéhyde, CC.
Spectroscopie de résonance magnétique nucléaire du proton : déplacement, blindage, valeurs
caractéristiques, protons équivalents, intégration, couplage spin-spin, règle des n+1-uplets, systèmes AnXp
et AmMpXq.
NB : tables à apporter en colle.
1
/
1
100%