classe de

Activité 10 — Casse-tête sur les mécanismes réactionnels
Activité réalisée au Cégep de Trois-Rivières par France Garnier.
1
CC+
YZ
CC
YZ
δ+
δ-
OH- +MgX
CORMgX
+
COH
R
H2O
+
Réactif de Grignard
C
RO
HO
H
+MgX
C
ROH
+
HO- +MgX
hydrolyse
CORMgX
+
1
δ-
CC+
YZ
δ+
CC
Y
+
Z
-
CC
YZ
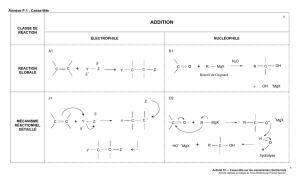
Annexe P.1 : Casse-tête
CLASSE DE
RÉACTION
ADDITION
ÉLECTROPHILE
NUCLÉOPHILE
RÉACTION
GLOBALE
A1
S1
MÉCANISME
RÉACTIONNEL
DÉTAILLÉ
J1
O2

Activité 10 — Casse-tête sur les mécanismes réactionnels
Activité réalisée au Cégep de Trois-Rivières par France Garnier.
2
CH2CH3
+MgBr
HO- +MgBr
H3C
H3C
COCH3CH2MgBr
+
CO
H3C
CH2CH3
CH3
H – OH
H3C
CH3
COH
+
éther anhydre
CH3CH2Br Mg
+
CH3CH2-Mg-Br
δ+
O
Et Et
¨
¨
O
Et Et
¨
¨
EXEMPLES
O1
H3C-CH-CH3
H3CCH = CH2 + H _Cl
δ+
δ-
Cl-
+
(le plus stable)
H3C-CH-CH3
Cl
(produit majeur)
et
H3C-CH2-CH2
+
Cl-
H3C-CH2-CH2Cl
(produit mineur)
H3C-CH-CH3
H3CCH = CH2 + H _Cl
δ+
δ-
Cl-
+
(le plus stable)
H3C-CH-CH3
Cl
(produit majeur)
et
H3C-CH2-CH2
+
Cl-
H3C-CH2-CH2Cl
(produit mineur)
M1
PARTICULARITÉS
U2
Application de la règle de Markovnikov :
Dans la réaction, l’électrophile se fixe de préférence sur le carbone le
plus hydrogéné de la liaison double (ou le moins substitué).
M2
Synthèse de l’organomagnésien (Grignard) :
L’éther aide à neutraliser la charge positive du Mg.
Dans un milieu anhydre parce que l’eau tend à déplacer l’éther.

Activité 10 — Casse-tête sur les mécanismes réactionnels
Activité réalisée au Cégep de Trois-Rivières par France Garnier.
3
CH2 – CH2
O
PARTICULARITÉS
T1
Nature des réactifs : polaires (Y-Z)
H-X (halogénation halogénure)
H-OH (hydrolyse alcool)
H-CN (hydrolyse nitrile)
Cl-OH (hydrolyse halohydrine
Nature des réactifs : non-polaires (Z2)
X2 (halogénation dihalogénure vicinal)
H2 (hydrogénation alcane)
Site actif : liaison double ou liaison triple
E1
Substrat produit
aldéhyde alcool
cétone alcool
ester alcool (double addition)
chlorure d’acide alcool (double addition)
anhydride alcool (double addition)
nitrile cétone
CO2 acide
alcool

Activité 10 — Casse-tête sur les mécanismes réactionnels
Activité réalisée au Cégep de Trois-Rivières par France Garnier.
4
CC
Y
z
Nu C C NuY
+++
En général (H)
(base forte)
Z -
CC
Y
z
Nu C C NuY
+++
En général (H)
(base forte)
Z -
CC
Y
z
Nu CCNuY
++
Z -
+
CC
Y
z
CC+
Y
Nu
+
C C
lent
rapide
NuY
+ +
Z -
CLASSE DE
RÉACTION
ÉLIMINATION
NUCLÉOPHILE
NUCLÉOPHILE
RÉACTION
GLOBALE
S2
A2
MÉCANISME
RÉACTIONNEL
DÉTAILLÉ
O3
E1 (en 2 étapes)
C
E2 (en 1 étape)
2

Activité 10 — Casse-tête sur les mécanismes réactionnels
Activité réalisée au Cégep de Trois-Rivières par France Garnier.
5
CH2
H
Cl
CH2H2C CH2NaCl
Na+OH
+++
-
H2O
CH3CH2CCH3
Cl
CH3
CH3CH2C+CH2
CH3
H
CH3CH2C CH2
CH3
+
H2O
NaCl +
(mineur)
Na+ OH -
CH3CH CCH3
CH3
OH-
Na+
+
H2O
NaCl +
(majeur)
Na+ OH -
+
CH3CH C+CH3
CH3
H
EXEMPLES
U3
Ou
T3
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%