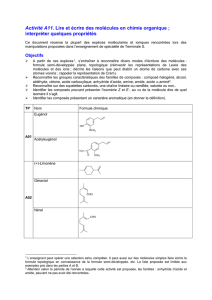
A11 – Activité – Lire et écrire des molécules de la chimie

Activité A11. Lire et écrire des molécules de la chimie organique ;
interpréter quelques propriétés
Ce document recense la plupart des espèces moléculaires et ioniques rencontrées lors des
manipulations proposées dans l’enseignement de spécialité de terminale S.
Objectifs
À partir de ces espèces
1
, s’entraîner à reconnaître divers modes d’écriture des molécules :
formule semi-développée plane, topologique (réinvestir les représentations de Lewis des
molécules et des ions ; décrire les liaisons que peut établir un atome de carbone avec ses
atomes voisins ; rappeler la représentation de Cram).
Reconnaître, les groupes caractéristiques des familles de composés : composé halogéné, alcool,
aldéhyde, cétone, acide carboxylique, anhydride d’acide, amine, amide, acide -aminé
2
.
Reconnaître sur des squelettes carbonés, une chaîne linéaire ou ramifiée, saturée ou non.
Identifier les composés pouvant présenter l’isomérie Z et E ; au vu de la molécule, dire de quel
isomère il s’agit.
Identifier les composés présentant un caractère aromatique (en donner la définition).
TP
Nom
Formule chimique
A01
Eugénol
OH OCH3
Acétyleugénol
CH3C
OOCH3
A02
(+)-Limonène
Géranial
CHO
Néral
CHO
1
. L’enseignant peut opérer une sélection et/ou compléter. Il peut aussi, sur des molécules simples, faire écrire la
formule topologique en connaissance de la formule semi-développée, etc. La liste proposée est limitée aux
exemples pris dans les parties A et B.
2
. Attention : selon la période de l’année à laquelle cette activité est proposée, les familles anhydride d’acide et
amide peuvent ne pas avoir été rencontrées.

A03
Acide myristique
HO (CH2)12
O
CH3
Trimyristine
O (CH2)12CH3
OCH3(CH2)12
O (CH2)12CH3
O
O
O
A04
Tanin de « Tara »
HO
HO
HO
C O
O
HO
OH
OH
HO C
OO
O
OH
C
C
O
OO C
OH
OH
O C
O
OH
OH
OH
OH
OH
O
Acide gallique
C
HO
OH
OH
O OH
Acide quinique
HO CO2H
HO OH OH
A05
Jaune de tartrazine
Na+, -O3S
N N
N
NHO
SO3-, Na+
CO-, Na+
O

Bleu patenté V
NC2H5
C2H5
-O3S-
N
OH
SO3-
C2H5
C2H5
, 1/2 Ca2+
Rouge cochenille
Na+, -O3SN N
Na+,-O3S
HO
SO3-, Na+
Rouge allura
Na+,-O3S
CH3
CO2-, Na+
N N
H3C
SO3-, Na+
A06
Aspirine
CO2H
OCOCH3
Caféine
N
O
CH3
O
CH3
N
N
CH3
A08
Aspartame
CH2
CHN
H
C
O
CHCH2
C
HO
O
C
OO CH3
NH2
Acide aspartique
C CH2
HO
CH
O
NH2
COH
O
Phénylalanine
CH2
CHH2N
COHO

Hernandulcine
OHO
Dulcine ou sucrol
OHN
ONH2
B1
4-aminophénol
(4-aminohydroxybenzène)
HO NH2
Paracétamol
(4-hydroxyacétanilide)
HO N C
H
CH3
O
B2
Butanone
O
Butan-2-ol
OH
B3
Alcool benzylique
CH2OH
Acide benzoïque
CO2H
B4
Méthanoate de propyle
H C
O
O
(CH2)2CH3
Acétate de n-butyle
CH3C
O
O
(CH2)3-CH3
Méthanoate (formiate)
d’éthyle
C
O
O
H
CH2-CH3

Butanoate d'éthyle
CH3CH2CH2C
O
O
CH2CH3
Acétate (éthanoate) de
benzyle
CH3C
O
O
CH2C6H5
ou O
O
CH3
Acétate de 3-méthylbutyle
(ou acétate d’isoamyle)
CH3C
O
O
(CH2)2CH(CH3)2
B5
Isoeugénol
OCH3
OH
Acétate d’isoeugénol
OCH3
CH3
C
O
O
Acétate de vanilline
C
H O
OCH3
CH3
C
O
O
Vanilline
COH
OCH3
OH
B6
4-heptyloxybenzaldéhyde
C7H15 O CO
H
 6
6
1
/
6
100%