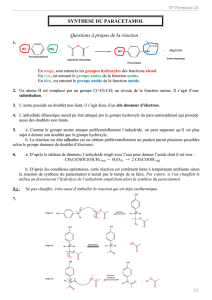
2. Le paracétamol

Ch 2.2 SYNTHESE D’UN AMIDE : LE PARACETAMOL
1. QU’EST-CE QU’UN AMIDE ?
1.1. Groupe amide :
Un amide est caractérisé par le groupe
Les différentes formules possibles sont :
1.2. Nomenclature :
Le nom des amides s’obtient à partir de celui de l’acide carboxylique en supprimant le mot acide et en remplaçant la
terminaison oïque par amide (exemple : CH3─ CO ─ NH2 s’appelle l’éthanamide)
On obtient un amide en faisant réagir une amine (R ─ NH2) avec soit un l’acide carboxylique à chaud (R’─ COOH) soit un
anhydride d’acide (R’─ CO ─ O ─ CO ─ R’’).
2. LE PARACETAMOL :
Le paracétamol (4-hydroxyacétanilide) a pour formule :
CH3 ─ CO ─ NH ─ C6H4 ─ OH
Le paracétamol a une activité analgésique et antipyrétique d'intensité comparable à celle de l'aspirine mais il n'a
pratiquement pas d'effet sur l'inflammation. Il n'a pas les effets secondaires de l'aspirine, il ne provoque pas de lésion de la
muqueuse gastrique et n'interfère pas avec l'agrégation plaquettaire (ne retarde pas la coagulation sanguine). Toutefois, des
doses excessives de paracétamol peuvent entraîner une nécrose hépatique.
Le début de son activité clinique date de 1893. Il est présent dans de nombreux médicaments (Doliprane, Dafalgan,
Efferalgan, …).
3. SYNTHESE DU PARACETAMOL :
3.1. Généralités
Remarque : quand les groupes hydroxyle ( OH) et amino (NH2) sont en position 1-4 sur un noyau benzénique, cette
position est appelée «para »
3.2. Dissolution du 4-aminophénol :
La réaction se faisant en phase liquide, il est nécessaire, dans un premier temps, de dissoudre le 4-aminophénol.
Cette dissolution se fait, à chaud, avec une solution d’acide éthanoïque.
1) Manipulation
2) Questions
« Cette dissolution se fait, à chaud, avec une solution d’acide éthanoïque ». Pourquoi à chaud ? Quel est le rôle de l’acide
éthanoïque ?
La solubilité du 4-aminophénol est plus importante à chaud qu’à froid.
De plus on le dissout dans une solution aqueuse d’acide éthanoïque : l’acide réagit avec le groupe
amine ─ NH2 et de fait accélère la dissolution.
C
O
N
C
O
NH2
C
O
NH
R
C
O
N
R
R'
CH3NH2OH
O
C
Paracétamol
(4-hydroxyacétanilide)
Anhydride
éthanoïque
Acide éthanoïque
CH3NH2OH
O
C
NH2
HO CH3
OO
CH3C O C
+ =
+ OH
O
CH3C
1-amino-4-hydroxybenzène
(para-aminophénol)

3.3. Synthèse du paracétamol :
1) Manipulation
2) Question
Calculer la quantité de matière des deux réactifs. Y en a-t-il un en excès ? Si oui, lequel ?
Para aminophénol = 4-aminophénol :
1
1
1
-2
m 2,8
n = = =2,6.10 mol
M 109
Anhydride éthanoïque :
2
2
2
-2
m 3,5 1,08
n = = =3,7.10 mol
M 102
Tous les coefficients de la réaction sont égaux à 1.
Donc le Para aminophénol est le réactif limitant.
Quelle masse de paracétamol peut-on théoriquement obtenir ?
-2
th max 1
m = ×M=n ×M=2,6.10 ×151=3,9gx
Calculer le rendement dans le cas du paracétamol brut obtenu précédemment.
th
3,1 100 79%
3
100 ,9
m
==
m
Quelle impureté a-t-on éliminée par filtration ?
On a éliminé l’acide éthanoïque ( celui présent initialement, celui formé lors de la réaction de
l’anhydride et l’eau et celui formé lors de la synthèse )
3.4. Purification du paracétamol brut par recristallisation :
1) Manipulation
2) Question
La technique de purification du paracétamol s’appelle recristallisation. Sur quelle propriété physique du paracétamol
s’appuie-t-elle ?
La technique de recristallisation est fondée sur la différence de solubilité du paracétamol à chaud et à
froid.
De façon générale, pour cette technique, on choisit un solvant dans lequel le solide est soluble à chaud
et peu soluble à froid. On ajoute le minimum de solvant.
La recristallisation doit être assez lente. Elle est amorcée par le choc thermique ou en faisant crisser
une baguette de verre contre la paroi.
Quelle(s)s impuretés a-ton éliminée(s) ?
L’acide éthanoïque restant sur les cristaux.
De façon générale, lors d’une recristallisation, il faut que les impuretés soient solubles à froid dans le
solvant.
Calculer le rendement de la synthèse en prenant pour produit final le paracétamol purifié. Comparer au résultat obtenu
précédemment.
th
10 2 100 51%
3,
0 9
m'
==
m
On constate que ’ < ( logique car il y a eu des pertes…)
1
/
2
100%