9 L`énergie chimiqu..

Chap 9 - simplifié : L'ENERGIE CHIMIQUE 1ère S
I] Cohésion de la matière.
1. Energie de liaison. Pour étudier la formation / dissociation des assemblages atomiques / ioniques, l'état G est pris pour référence.
Ex : 2 atomes isolés H et Cl peuvent se lier pour former la molécule HCl : H + Cl HCl. Le système cède l'énergie E = 7.10-19 J.
La transformation inverse consiste à rompre la liaison H–Cl : HCl H + Cl. Il faut fournir au milieu réactionnel E = 7.10-19 J.
la nature des atomes, la formation d'une liaison
entre ces atomes correspond toujours à une libération
d'énergie. Inversement, la rupture d'une liaison
nécessite toujours un apport d'énergie de la part du
milieu extérieur.
L'énergie de liaison DA-B est l'énergie à fournir à une
température donnée, pour dissocier une mole de
molécules AB à l'état gazeux en une mole d'atomes A
et une mole d'atomes B à l'état gazeux. Elle s'exprime
en J.mol-1 ou en kJ.mol-1.
Ceci peut être représenté sur un
diagramme d'énergie.
Tableau donnant quelques énergies de liaison à 25 °C:
1. Dans des molécules diatomiques.
2. Dans des molécules polyatomiques.
Lorsqu'une molécule comporte plusieurs liaisons covalentes, on appelle énergie de cohésion de la molécule, l'énergie qu'il faut
fournir, à une température donnée, à une mole de molécules à l'état gazeux pour rompre toutes les liaisons intramoléculaires
et obtenir des atomes isolés à l'état gazeux.
Cette énergie de cohésion se calcule à partir des énergies moyennes de liaison fournies par les tables précédentes.
Ex : énergie de cohésion du propène CH2=CH–CH3 : E cohésion = 348 + 612 + 6 410 = 3420 kJ.mol-1.
2. Energie de cohésion d'un solide ou d'un liquide moléculaire.
L'énergie de cohésion d'un S ou L moléculaire est l'énergie qu'il faut fournir
à une mole du S ou du L pour l'amener à l'état gazeux, l'état initial et l'état
final étant à la même T.
L'énergie de cohésion est également l'énergie qu'il faut fournir pour rompre
les liaisons intermoléculaires et disperser les molécules constituant le solide
ou le liquide.
NB : intramoléculaire = au sein d'1 molécule. Intermoléculaire = entre les molécules.
Cette énergie de cohésion est en général dix + faible qu'une énergie de liaison car les liaisons intermoléculaires sont + faciles à
rompre que les liaisons intramoléculaires.
II] Aspect énergétique des transformations de la matière.
1. Les transferts d'énergie. Par convention, les variations d'énergie d'1 syst sont comptées t s'il reçoit de l'énergie et t s'il en perd.
Si un système est isolé, c'est à dire qu'il n'échange pas d'énergie avec le milieu extérieur, son énergie se conserve.
Pour 1 système en interaction avec le milieu extérieur, l'énergie reçue par le système vaut celle cédée par l'extérieur.
Dans le cas général de plusieurs systèmes en interaction, la somme algébrique des variations d'énergie des systèmes
intervenant lors d'une transformation (physique ou chimique) est nulle.
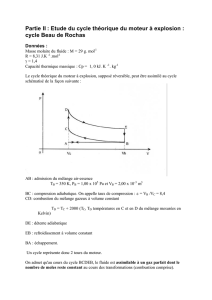
2. Bilan énergétique d'un changement d'état. Simulateur Microméga Hatier
Variations d'un système constitué d'eau (solide, liquide ou vapeur) en fonction
de la température.
L'énergie apportée par l'extérieur sert à augmenter la T°C du glaçon de
–10°C à 0°C.
L'énergie apportée par l'extérieur ne modifie pas la T°C du glaçon mais le
fait fondre.
L'énergie apportée par l'extérieur sert à augmenter la T°C de l'eau liquide
de 0°C et 100 °C.
L'énergie apportée par l'extérieur fait bouillir l'eau et la vaporise.
La T°C de la vapeur d'eau peut augmenter si l'apport d'énergie se poursuit.
On appelle chaleur latente de changement d'état d'une espèce chimique, l'énergie échangée sous forme de chaleur avec le
milieu extérieur à p et T constantes, par une mole de cette espèce chimique, lors du changement d'état considéré.

Une chaleur latente se note Q ou L en J.mol-1. Voir tableau page 193.
Rq : la chaleur latente de vaporisation ou d'ébullition, est égale à l'énergie de cohésion du liquide pris à sa température d'ébullition.
3. Energie mise en jeu lors d'une réaction chimique.
Ex : 2 C4H10(g) + 13 O2(g) 8 CO2(g) + 10 H2O(g) Cette réaction libère une énergie E transférée au milieu extérieur % x.
Le coefficient de proportionnalité est noté Qr, il est de même signe que E. Pour cette réaction : Qr = - 5210 kJ.mol-1.
L'énergie qu'un système échange sous forme de chaleur avec le milieu extérieur, au cours d'une réaction chimique d'équation
donnée et pour laquelle l'état initial et l'état final sont à la même T et à la même p, à pour expression :
E = x . Qr unités J, mol, J.mol-1. Qr est la chaleur de réaction.
Si E < 0: la réaction est exothermique. Si E > 0: la réaction est endothermique. Si E = 0: la réaction est athermique.
Ex : déterminons E lors de la combustion, dans un excès de O2 de 145 g de butane de masse molaire 58,0 g.mol-1. nbutane = 2,5 mol.
2 C4H10(g)
13 O2(g)
8 CO2(g)
10 H2O(g)
Etat
Avancement
Energie E (kJ)
Quantité de matière
Quantité de matière
Quantité de matière
Quantité de matière
Initial
0
0
2,50
excès
0
0
Intermédiaire
x
x Qr
2,50 –2x
excès
8 x
10 x
Final
xmax
xmax Qr
2,50 – 2xmax
excès
8 xmax
10 xmax
Le butane est limitant : xmax = 1,25 mol E = 1,25 (-5210) = - 6513 J.
E est cédée au milieu extérieur sous forme de chaleur lors de la combustion de 2,50 mol de butane.
NB: la chaleur de réaction Qr se définit pour un avancement de 1 mol de la réaction.
4. Interprétation microscopique.
Ex : synthèse du chlorure d'hydrogène à 25°C : H2(g) + Cl2(g) 2 HCl(g) Qr = -184 kJ.mol-1.
On peut décomposer le mécanisme de cette réaction en 2 étapes :
H2(g) + Cl2(g) 2 H(g) + 2 Cl(g) : rupture des liaisons H – H et Cl – Cl. Pour 1 mole de H2(g) et de Cl2(g) E = 432+240 = 672 kJ.
2 H(g) + 2 Cl(g) 2 HCl(g) : A partir de 2 de 2 moles de H(g) et Cl(g) E =– 2 428 = – 856 kJ.
Au final, E = 672 – 856 = –184 kJ pour 2 moles de HCl(g) formées(avancement x = 1 mol).
NB: il est indispensable de préciser l'état physique de chaque réactif et
de chaque produit car pour une même espèce il ne faudrait pas
oublier de comptabiliser d'éventuelles chaleurs latentes de changement
d'état.
La chaleur de réaction relative à une équation dont les réactifs et
les produits sont à l'état gazeux, est égale à la somme des énergies
des liaisons rompues diminuées de celle des liaisons formées :
Qr = Dliaisons rompues – Dliaisons formées
III] Application au quotidien.
1. Réactions chimiques de combustion.
La combustion complète des hydrocarbures (S, L, G) produit du dioxyde de carbone et de l'eau. Elle est caractérisée par une chaleur
de réaction Qcomb < 0 puisqu'une telle réaction est exothermique.
Ex : 2 C4H10(g) + 13 O2(g) 8 CO2(g) + 10 H2O(g)
Qcomb = 6 DC–C + 20 DC–H + 13 DO=O – 16 DC=O – 20 DO=H = 6 348 + 20 410 + 13 494 – 16 795 –20 460 = - 5210 kJ.mol-1.
2. Enjeu économique.
L'efficacité des divers combustibles utilisés pour le chauffage se compare grâce à leur pouvoir calorifique :
Le pouvoir calorifique d'un combustible est l'énergie transférable sous forme de chaleur à l'environnement lors de la
combustion complète d'un kilogramme de combustible. Il s'exprime en J.kg-1.
Ex : H2 : Pc = 142.500 kJ.kg-1. Voir tableau page 196.
Rendement d'une réaction de combustion : =
utiliséecombustiblducomplètecombustionlaparfournieénergie chaufferàsystèmeleparreçueenteffectiveménergie
La différence est perdue inutilement dans l'air ou les objets environnants.
3. Enjeu écologique des combustions.
Les réactions de combustion mises en jeu dans le chauffage et les transports engendrent un phénomène de pollution néfaste pour
l'environnement.
1
/
2
100%