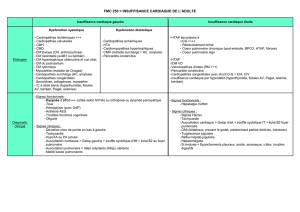
Cannesson M - ( PDF - 136.4 ko)

Anesthésie pour Chirurgie Non Cardiaque chez le Patient Adulte Porteur
d’une Cardiopathie Congénitale
Maxime Cannesson
Service d’Anesthésie Réanimation
Hôpital Cardiovasculaire et Pneumologique Louis Pradel
28, avenue du Doyen Lépine
69500 LYON-BRON
1. INTRODUCTION
Les malformations cardiaques congénitales se rencontrent chez près de 0,8 % des naissances
et sont l’une des malformations congénitales les plus fréquentes[1]. Avant l’avènement de la
chirurgie cardiaque néonatale et pédiatrique, les chances de survie jusqu’à l’âge adulte ne
dépassaient pas les 20 %[2]. Aujourd’hui, plus de 85 % des enfants qui naissent avec une
cardiopathie congénitale vont atteindre l’âge adulte. Les survies à 15 ans des patients porteurs
de cardiopathies congénitales simples ou complexes sont de 95 % et 80 % respectivement et
la moitié des patients présentant une cardiopathie complexe a plus de 25 ans[1, 3]. Enfin, on
estime que la croissance annuelle de cette population est de l’ordre de 5 % [4]. On comprend
donc aisément que nous serons de plus en plus souvent confrontés à ce type de patients dans
le cadre de la prise en charge anesthésique pour chirurgie non cardiaque, et en particulier en
obstétrique. Cette prise en charge va donc devoir être codifiée en raison de la complexité que
représente la compréhension de cette physiopathologie très particulière et en raison du rôle
central que joue l’anesthésiste réanimateur dans la filière médico-chirurgicale[5]. La nature
des problèmes cardiaques sous-jacents est très différente de celle rencontrée dans les
cardiopathies congénitales du nouveau-né ou du nourrisson. Un grand nombre de ces patients
va nécessiter un suivi cardiologique à vie en raison du fait que la chirurgie réalisée dans
l’enfance était palliative et non correctrice.
De manière générale ces adultes porteurs de cardiopathies congénitales sont répartis en trois
grandes catégories :
1) les patients qui ont bénéficié d’une chirurgie cardiaque réparatrice dans l’enfance
2) les patients chez qui la chirurgie réalisée dans l’enfance était une chirurgie palliative
3) les patients chez qui ni la chirurgie réparatrice, ni la chirurgie palliative n’ont été
réalisées
Ce dernier groupe de patients peut se rencontrer dans de nombreuses situations. Il existe
encore des patients chez lesquels le diagnostic n’a pas été posé avant l’âge adulte (on pense en
particulier à la communication inter- auriculaire (CIA) ou à la coarctation de l’aorte (CoA).
Les patients chez qui les circulations systémiques et pulmonaires sont équilibrées peuvent
rester asymptomatiques jusqu’à ce que cette balance entre les deux circulations soit perturbée.
A côté de ces patients on retrouve les patients qui auront été jugés inopérables dans l’enfance
ou encore les patients en provenance de pays ne disposant pas des plateaux techniques
nécessaires à la chirurgie cardiaque néonatale et pédiatrique. Ce groupe de patients non opérés
représente probablement le groupe le plus difficile à prendre en charge dans notre spécialité.
En effet, ces patients sont soumis à l’hypoxie chronique ainsi qu’à des modifications du débit
sanguin pulmonaire entraînant le plus souvent des variations physiologiques majeures.
La chirurgie cardiaque pédiatrique a été véritablement bouleversée au cours des 50 dernières
années. Certaines interventions palliatives ont été abandonnées, d’autres sont apparues avec
1

l’apparition de chirurgies complexes parfois réalisées en plusieurs étapes pour les pathologies
les plus difficiles. Par conséquent, la physiopathologie de ces patients a elle aussi changée au
cours de ces dernières années. De manière générale, l’évolution des cardiopathies
congénitales de l’adulte entraîne cinq grands groupes de complications : l’hypertension
artérielle pulmonaire (HTAP), la cyanose, les réinterventions chirurgicales, les troubles du
rythme cardiaque (TdR) et les défaillances ventriculaires droite ou gauche. Dans cette revue
nous nous proposons de rappeler la classification des cardiopathies congénitales, puis de faire
le point sur la prise en charge anesthésique de ces patients, sur les complications les plus
fréquemment rencontrées dans cette population, puis de détailler les pathologies spécifiques
les plus fréquentes.
2. CLASSIFICATIONS DES CARDIOPATHIES CONGENITALES
La grande diversité des cardiopathies congénitales et des chirurgies associées impose une
classification anatomique stricte dont la connaissance permet de comprendre la
physiopathologie. De manière générale, on peut classer les pathologies selon leur anatomie et,
suivant les anomalies observées, on peut les regrouper en pathologies spécifiques.
2.1. Classification anatomique
Sur le plan anatomique le cœur est divisé en 3 segments (oreillettes, ventricules, troncs
artériels) séparés par 2 jonctions (auriculo-ventriculaires et ventriculo-artérielles). Il faut noter
d’emblée que les différentes structures sont définies par des critères morphologiques puisque
les critères de position et de taille ne sont pas pertinents dans le cadre des cardiopathies
congénitales. Dans l’analyse des structures on distingue 5 caractéristiques :
- Le situs : il est dit solitus (normal) quand la position du cœur est normale dans le
thorax avec l’apex orienté vers la gauche. Il est dit inversus dans le cas contraire.
- La concordance des segments successifs : la disposition est dit concordante si les
segments successifs se suivent dans l’ordre anatomique normal. Dans le cas contraire
on parle de discordance.
- La connexion des segments : le canal atrioventriculaire fait la jonction entre les
oreillettes et les ventricules, l’infundibulum fait la jonction entre les ventricules et les
troncs artériels.
- Caractéristiques morphologiques des différentes structures : le ventricule gauche
(VG) est défini par 2 muscles papillaires, une valve mitrale et une chambre de chasse
en partie fibreuse, le ventricule droit (VD) est défini par 3 muscles papillaires (dont
l’un s’insère sur le septum), une valve tricuspide (dont l’insertion septale est plus
antérieure que l’anneau mitral) et une chambre de chasse complètement musculaire.
- Les anomalies associées : cavités cardiaques dysmorphiques, lésions obstructives,
defects septaux.
2.2. Classification physiologique (Tableau 1)
Les shunts sont soit intracardiaques (CIA ou communication interventriculaire (CIV)) soit
extracardiaques au niveau des veines pulmonaires (connexion anormales des veines
pulmonaires) ou des grandes artères (canal artériel persistant ou ductus arteriosus , fistule
aorto-pulmonaire, fistule coronaires). On définit le shunt à partir de 3 caractéristiques
principales :
- La direction du flux : un shunt peut être gauche-droit, droit-gauche ou bidirectionnel. Il faut
noter d’emblée que le shunt droit-gauche est responsable d’une cyanose puisque le sang
veineux systémique passe dans la circulation artérielle systémique. Sur le plan
physiopathologique le débit du shunt augmente lorsque la pression d’amont augmente et/ou
quand la pression d’aval diminue. On comprend donc aisément qu’un shunt droit-gauche est
2

majoré en cas de vasodilatation artérielle systémique tandis qu’un shunt gauche-droit diminue
dans cette situation. De même, les shunts cyanogènes (droit-gauche) seront diminués en cas
de diminution des résistances artérielles pulmonaires ou, de manières générale, de la
postcharge ventriculaire droite.
- Les dimensions de la communication : un petit shunt (restrictif) n’autorise le passage que
d’une petite quantité de sang mais est responsable d’un gradient de pression important. A
l’inverse, un shunt de grande dimension entraîne un débit important mais un faible gradient de
pression.
- Le retentissement du shunt sur les cavités d’admission : en cas de communication située en
amont des valves auriculo-ventriculaires on observe une dilatation des cavités droites (CIA,
retour veineux pulmonaire anormal). Dans le cas d’une communication située en aval des
valves auriculo-ventriculaires (CIV, canal artériel persistant) on observe une dilatation des
cavités gauches. Dans tous les cas, le débit pulmonaire est augmenté et l’artère pulmonaire
(AP) est dilatée.
Il faut noter que l’hyperdébit pulmonaire, s’il se pérennise, va entraîner une altération de
l’endothélium des artérioles pulmonaires qui peut conduire au phénomène d’Eisenmenger. Ce
phénomène est responsable d’une augmentation progressive et irréversible des résistances
artérielles pulmonaires qui va induire l’apparition d’une HTAP qui peut devenir
suprasystémique. Dans cette situation, un shunt initialement gauche-droit va devenir droit-
gauche. Ce phénomène est détaillé dans le chapitre 4.4.
L’importance d’un shunt est appréciée sur le rapport entre les débits systémiques et
pulmonaires (Qp/Qs). Ce rapport peut être mesuré par cathétérisme ou par échocardiographie.
Les shunts gauche-droits entraînent une augmentation du rapport Qp/Qs > 1 puisqu’il y a
passage de sang artériel systémique vers la circulation pulmonaire. Dans le cas du shunt droit-
gauche, le phénomène est inverse (Qp/Qs < 1).
3. PRINCIPES GENERAUX DE LA PRISE EN CHARGE ANESTHESIQUE
3.1. Présentation et stratégie générale de prise en charge
Dans la grande majorité des cas, les patients porteurs d’une anomalie cardiaque congénitale
ont été pris en charge dès l’enfance dans un centre spécialisé. Cependant, avec l’âge, ces
patients vont souvent s’éloigner de leur centre de référence initial. Par conséquent, avec
l’augmentation du nombre de patients adultes porteurs de cardiopathie congénitale, les centres
non spécialisés vont être amenés à rencontrer ce type de patients de plus en plus souvent[6].
En particulier, les femmes porteuses de cardiopathies congénitales sont fréquemment amenées
à consulter un anesthésiste dans le cadre de la prise en charge obstétricale. Ce type de prise en
charge doit reposer sur une étroite collaboration entre cardiopédiatres, chirurgien et
anesthésistes, chacun d’entre eux ayant une connaissance spécifique de la pathologie
concernée et de la physiopathologie périobstétricale. Certaines pathologies sont très bien
tolérées pendant la grossesse tandis que d’autres peuvent se décompenser rapidement et de
manière dramatique. Dans ces cas particuliers il est essentiel d’entourer la grossesse et de
prévoir longtemps à l’avance la prise en charge anesthésique et obstétricale de
l’accouchement. Plus de la moitié des patientes porteuses d’une cardiopathie congénitale
cyanogène vont décompenser pendant la grossesse tandis que seules 15 % des patientes non
cyanosées vont décompenser[7]. L’insuffisance cardiaque congestive est également associée à
une augmentation du risque pendant la grossesse et l’HTAP est responsable du décès maternel
de près de 30 % des patientes qui présentent un syndrome d’Eisenmenger[8]. Outre le risque
maternel il existe aussi un risque non négligeable pour le fœtus. Ainsi, on rapporte jusqu’à
50 % de mortalité chez les fœtus dont les mères ont une saturation artérielle en oxygène <
85 % ou un hématocrite > 65 %[9].
3

Près de 20 % des patients adultes porteurs d’une cardiopathie congénitale qui sont hospitalisés
en urgence, toutes causes confondues, vont mourir ou nécessiter la transplantation cardiaque
dans les trois ans qui suivent cette hospitalisation[10]. Les facteurs de risque de complications
postopératoires chez ces patients sont la cyanose, l’insuffisance cardiaque congestive, le
mauvais état général et le jeune âge[11]. Pour les patients les plus à risque il semble important
d’organiser une prise en charge dans un milieu spécialisé ayant une bonne connaissance de la
pathologie cardiaque congénitale et disposant de l’ensemble du plateau technique de
réanimation postopératoire[5].
3.2. Prise en charge anesthésique
La prise en charge des patients adultes porteurs d’une cardiopathie congénitale dans le cadre
de la chirurgie non cardiaque repose avant tout sur une compréhension parfaite de la
physiopathologie et du statut fonctionnel du patient appréciés par les données
échocardiographiques, les données du cathétérisme cardiaque, les comptes rendus des
interventions précédentes et l’examen clinique. Encore une fois, la prise en charge doit être
multidisciplinaire avec une coopération entre chirurgiens, cardiologues, et anesthésistes
réanimateurs. Sur le plan de la prise en charge anesthésique à proprement parler, il n’existe
pas encore de recommandation générale. La prise en charge doit être adaptée à chaque cas. En
effet, l’éventail des patients porteurs d’une cardiopathie congénitale est très large et va du
patient totalement asymptomatique au patient souffrant d’une grande invalidité liée à sa
maladie cardiaque. Le choix de la technique anesthésique est donc guidé par la pathologie et
par le statut du patient, ainsi que par la chirurgie pour lequel il est adressé. A la consultation
d’anesthésie il est primordial d’insister sur l’ensemble des antécédents cardiaques et
chirurgicaux (Tableau 2). Il faut détailler l’ensemble des traitements pris par le patient.
L’examen clinique doit absolument reporter les constantes hémodynamiques (pression
artérielle, fréquence cardiaque) ainsi que la SpO2 en air ambiant. Il faut évidemment noter les
signes cliniques d’insuffisance cardiaque et/ou ceux évocateurs de troubles du rythme
cardiaque. Sur le plan biologique il faut se rappeler qu’il est fréquent d’observer une
polyglobulie avec des hématocrites parfois supérieurs à 60 % chez les patients souffrant d’une
cardiopathie cyanogène chronique.
3.2.1. Prémédication
La prémédication de ces patients doit être prudente. En effet, chez les patients porteurs d’une
cardiopathie cyanogène (soit par un shunt droit-gauche, soit par un obstacle sur les voies
pulmonaires), l’hypoventilation et l’hypoxie vont avoir des effets délétères rapides et graves
sur la physiologie circulatoire. Il faut donc nuancer la prémédication chez ces patients. Elle
pourra consister par exemple en une prémédication légère sans opiacés. Par ailleurs, toujours
chez les patients cyanosés, la hausse de l’hématocrite générée par l’hypoxie chronique majore
le risque de déshydratation, d’acidose et de thrombose périopératoire. Il faut donc veiller à
prévenir ces complications en préopératoire chez ce type de patients.
3.2.3. Monitorage au bloc opératoire
Evidemment, le monitorage le plus simple et cependant le plus important est le monitorage de
la SpO2. Il permet d’obtenir des informations sur le débit pulmonaire et sur les variations du
rapport Qp/Qs. Il est en revanche sans intérêt sur le monitorage de ce rapport en cas de shunt
gauche-droit avec un Qp/Qs > 3 : 1. Pour le monitorage des saturations artérielles les plus
basses certains oxymètres de pouls peuvent être pris en défaut. Il convient dans ce cas d’avoir
recours à des oxymètres fiables dans ces conditions de saturations extrêmes. Le monitorage de
la pression artérielle de manière non invasive doit être systématique avant la mise en place
éventuelle d’un cathéter artériel. Cependant, il faut se souvenir qu’en cas d’antécédent
4

d’intervention de type Blalock-Taussig (anastomose systémico-pulmonaire centrale entre une
artère sous-clavière et une artère pulmonaire) la pression artérielle ne peut être mesurée du
côté de l’anastomose. En ce qui concerne le monitorage de la capnographie, il faut savoir que
la PETCO2 sous estime de manière constante la PaCO2 en cas de shunt droit-gauche en raison
de l’espace mort représenté par le volume de sang qui ne parvient pas aux poumons. Cette
sous estimation est d’autant plus importante que le shunt est important [12, 13].
Le monitorage invasif est à discuter au cas par cas en fonction de la pathologie cardiaque et de
la chirurgie envisagée. De manière générale, il faut éviter toute embolie gazeuse lors de la
mise en place d’un monitorage invasif en raison du risque d’embolie gazeuse cérébrale en cas
de shunt droit-gauche. La mise en place d’une voie veineuse centrale en territoire cave
supérieure doit être prudente. Cette mise en place doit être précédée de la lecture détaillée de
l’échocardiographie préopératoire ainsi que des comptes-rendus chirurgicaux précédents
(selon les cas) afin de s’assurer de l’absence d’anomalie du retour veineux systémique. Il faut
se rappeler que chez les patients présentant des antécédents d’anastomose cavo-pulmonaire la
pression mesurée avec le cathéter veineux central est la pression de retour dans l’artère
pulmonaire puisque le ventricule droit est « shunté » dans cette situation. La question de
l’utilisation du cathéter artériel pulmonaire doit être discutée. En effet, outre les problèmes
liés à la mise en place de ces cathéters, les soucis d’interprétation et de fiabilité des données
obtenues en cas de shunt intracardiaque et d’insuffisance tricuspide en limitent l’utilité. En
revanche, l’échocardiographie transœsophagienne permet l’analyse de la fonction
ventriculaire, du remplissage et du débit cardiaque de manière probablement plus intéressante.
3.2.4. Induction et entretien de l’anesthésie
De manière générale, le choix des agents anesthésiques va reposer sur leurs propriétés
hémodynamiques. La plupart des agents anesthésiques entraînent une diminution des
résistances vasculaires systémiques qui peut majorer un shunt droit-gauche par baisse de la
post-charge ventriculaire gauche. Dans ce type de situation, la désaturation, qui est d’origine
hémodynamique, peut être contrôlée par l’administration d’un agent vasopresseur.
L’étomidate est l’agent anesthésique qui offre la meilleure stabilité hémodynamique. Les
agents inhalés tels que l’isoflurane, l’halothane et le sévoflurane ne modifient pas
l’importance du shunt gauche-droit lors de l’induction avec une FiO2 à 100 %[14]. On doit se
rappeler que les shunts droit-gauches modifient le délai d’action des agents de l’anesthésie.
Ainsi, le shunt droit-gauche accélère l’effet des agents intraveineux puisqu’ils vont
rapidement passer de la circulation cave à la circulation artérielle systémique. A l’inverse,
l’induction par inhalation est ralentie dans ce type de pathologie en raison d’une diminution
du débit pulmonaire [15].
Au cours de l’entretien de l’anesthésie il est important de maintenir le patient en
normothermie en raison de la vasoconstriction et des troubles de la coagulation induits par
l’hypothermie.
La question de l’anesthésie locorégionale doit être discutée. Il n’existe pas pour le moment de
recommandations précises. Cependant, on doit garder à l’esprit les effets cardio-vasculaires de
la rachianesthésie ou de l’anesthésie péridurale dans ce contexte. Ces effets sont les suivants :
vasodilatation artérielle aggravant un shunt droit-gauche et diminuant le débit à travers une
anastomose systémico-pulmonaire[16], diminution de la précharge ventriculaire et
impossibilité d’hyperventiler les patients, qui permet , lors de l’anesthésie générale, de
diminuer les résistances vasculaires pulmonaires et de limiter l’HTAP.
De manière générale on doit se souvenir des grands principes suivants [17] :
- Shunt gauche-droit : il faut éviter d’augmenter les résistances vasculaires systémiques
en raison du risque de majoration du shunt. Les anesthésies péridurales et rachidiennes
sont indiquées pour l’accouchement et la césarienne.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%