plaquette L3S5 2011-2012 - Université Paris Diderot

L3 S5 : Premier Semestre
TRONC COMMUN
Parcours BBM
Parcours BEE
PROGRAMME des COURS, TD, TP
UFR Sciences du Vivant : Bâtiment Lamarck - Case 7044
35 rue Hélène Brion - 75205 Paris Cedex 13
Scolarité : Marie CHARGELÈGUE
e-mail : marie.chargelegue@univ-paris-diderot.fr
01 57 27 82 30
Directrice des Etudes : Josiane WANTYGHEM
e-mail : josiane.wantyghem@univ-paris-diderot.fr
01 57 27 82 51
UFR SCIENCES du VIVANT
ANNÉE 2011 / 2012
L3
mention : Sciences du Vivant
Parcours BIOCHIMIE et BIOLOGIE MOLÉCULAIRE
Parcours BIOTECHNOLOGIE et
ÉCONOMIE de l’ENTREPRISE

FEUILLE de ROUTE : Année 2011-2012
Les Licences de Biochimie Biologie Moléculaire (BBM) et de Biotechnologie et Economie d’Entreprise
(BEE) comportent 6 semestres. Le niveau L3 correspond aux semestres S5 et S6.
Le semestre L3S5 présenté dans ce document est commun aux 2 parcours.
Il est constitué de 4 UE (Unité d’Enseignement) :
• UE
30
UA
CM
35 Métabolisme et Chimie (4 + 4 ECTS)
• UE
30
UB
ES
35 Enzymologie et Structure (4 + 4 ECTS)
• UE
30
UC
BG
35 Biologie Moléculaire et Génétique (6 + 2 ECTS)
• UE
30
UD
TP
35 Travaux pratiques à thème (6 ECTS)
Un semestre comporte 30 ECTS (European credit transfert system).
Rappel : 1 ECTS (ou crédit) correspond à 10 h de présence + 10 h de travail personnel.
Contrôle des connaissances
La note attribuée à chaque matière des UE UA-UC est la somme d’un contrôle dit partiel ou continu et de
l’examen final. La participation exacte du contrôle continu sera affichée en octobre.
Les contrôles continus sont obligatoires. Seuls les étudiants travaillant plus de 25 h par semaine
pourront obtenir une dispense à condition qu’ils en fassent la demande avant le 23 octobre, avec
un justificatif de leur activité.
La note de l’UE de TP est la moyenne des notes obtenues à chaque séance de TP et de la note obtenue au
cours d’hygiène et sécurité.
A chaque matière est attribué un coefficient qui correspond aux ECTS.
La session d’examen pour le semestre S
5 aura lieu du 03 au 18 janvier 2012.
Validation du diplôme de la licence
Chaque semestre doit être validé individuellement.
Au sein d’un semestre, les UEs se compensent entre elles.
Au sein de la même UE, les 2 matières se compensent.
Une compensation entre semestres pourra être accordée exceptionnellement par le jury de la Licence.
Cette indulgence ne pourra vous être accordée qu’une seule fois sur les 3 années de licence.
Quelques rappels :
• Les TD et les TP sont obligatoires.
• Lors de l’inscription pédagogique, vous choisissez un groupe de TD (5 possibles) et un groupe de TP
(8 possibles). Vous devez respecter les horaires correspondant à votre groupe pour chaque matière.
• Votre absence lors d’un TP ou toute absence prolongée devront être signalées (au secrétariat de
Licence ou à J. Wantyghem). Une absence non justifiée sera sanctionnée par un zéro.
Pour toutes les informations concernant l’organisation de l’enseignement (programme, modalités de contrôle
des connaissances….), vous pourrez vous connecter sur le portail ENT de l’Université.
Vie étudiante à l’Université P7
Des élections auront lieu en cours d’année aux différents conseils de l’Université et de l’UFR.
Il est important que vous envisagiez d’être candidat. C’est le meilleur moyen pour faire bouger les choses…
et nous avons besoin de vous.
Association Etudiants : Scivip7.Org (scivip7@gmail.com)
Information sur le second semestre : une réunion aura lieu fin novembre/début décembre pour vous guider
dans vos choix du second semestre.
La plaquette correspondant aux options du second semestre (L3S6) peut être consultée sur le site de l’UFR
Sciences du Vivant.
VACANCES : du 16 décembre 2011 au 2 janvier 2011

PROGRAMME des DIFFÉRENTES U E
30 BM EN
35 E
N
Z
Y
M
O
L
O
G
I
E 4 ECTS
Enseignants : J-M.
Dupret, F.
Rodrigues-Lima, V.
Arluison, J.
Dairou, W.
Grange
Cours : 24 heures - TD : 18 heures
PROGRAMME des COURS
1
CINÉTIQUE RÉACTIONNELLE et ÉQUILIBRES CHIMIQUES
Vitesse de réactions et constantes de vitesse de premier et deuxième ordres.
Equilibres chimiques.
Cinétique de formation des complexes.
2
RÉACTION ENZYMATIQUE à UN SUBSTRAT
Rappels sur les propriétés générales des enzymes.
Modèles cinétiques.
Hypothèse de l’état stationnaire.
3
ANALYSE et SIGNIFICATION des PARAMÈTRES CINÉTIQUES
Caractéristiques cinétiques des enzymes michaeliennes.
Détermination pratique des paramètres cinétiques.
Signification physique des paramètres cinétiques k
cat
, K
M
, k
cat
/
K
M
Effet du pH sur les paramètres cinétiques.
4
CATALYSE ENZYMATIQUE
Les principaux mécanismes de catalyse : Catalyse acide-base.
Catalyse covalente nucléophile ou électrophile.
5-6
ENZYMES de DÉGRADATION des PROTÉINES
i) Structure et fonction de protéases.
ii) Mécanisme catalytique des protéases à sérine et à cystéine.
iii) Implications pathologiques et thérapeutiques.
7-8
INHIBITEURS d’ENZYMES et LEUR RÔLE THÉRAPEUTIQUE
Rôle et intérêt thérapeutique des inhibiteurs d’enzymes.
i) Inhibiteurs réversibles immédiats et à interaction lente.
ii) Inhibiteurs irréversibles covalents : marqueurs d’affinité, inhibiteurs-suicide.
iii) Application à des problèmes thérapeutiques majeurs.
9-10
IDENTIFICATION de RÉSIDUS ESSENTIELS par MARQUAGE CHIMIQUE et MUTAGENÈSE DIRIGÉE
11
CINÉTIQUES à DEUX SUBSTRATS et DEUX PRODUITS
Principaux types de réactions et de mécanismes à deux substrats et deux produits, séquentiels (aléatoires
ou ordonnés) et non séquentiels (ping-pong).
PROGRAMME des TRAVAUX DIRIGÉS
1 - Cinétiques d’ordre I et pseudo-premier ordre
Ordre de réaction (ordres zéro, un, pseudo 1
er
ordre), loi de vitesse, constantes de vitesse.
Ex : Cinétiques d'association apoenzyme
/
coenzyme, de dissociation d'un complexe récepteur hormone
par dilution isotopique, de modification chimique de groupements NH
2
d'une protéine par acétylation….
2 - Interactions protéine - ligand et équilibres
Complexes protéine
-
ligand. Détermination et signification de K
D
, fonction de saturation, fraction de sites
occupés. Représentation de Scatchard et autres représentations.
Ex : Interaction anticorps
-
antigène, comparaison de liaisons à haute et basse affinité.
Exemple du complexe entre la NO
-
synthase et son substrat, l’arginine.
3 - Equation de Michaelis - Vitesse initiale - Etat stationnaire - Constantes cinétiques
Etude sur des exemples des courbes [P] = f (t), [S] = f (t); v
i
= f ([S
0
]); V
max
= f ([E]).
Equation de Michaelis. Détermination et signification des constantes cinétiques K
M
, k
cat
, k
cat
/
K
M
.
4 - Mécanismes de catalyse enzymatique
Catalyse enzymatique : catalyse générale acide et basique, catalyse électrophile par les métaux, catalyses
covalentes nucléophile et électrophile.

5 - Les enzymes de dégradation des protéines
Intermédiaires multiples dans les réactions enzymatiques à plusieurs étapes.
α-Chymotrypsine : mise en évidence de l'acyl-enzyme ; détermination des constantes de vitesse (état pré-
stationnaire, état stationnaire).
Caspases : mécanisme et intermédiaires de réaction.
Subtilisine : mise en évidence d’acides aminés essentiels par mutagenèse dirigée,
comparaison des constantes cinétiques. Mécanisme catalytique.
6,
7 - Inhibiteurs réversibles et inhibiteurs covalents - Analogues de l’état de transition - Marqueurs
d’affinité - Inhibiteurs suicides
Caractéristiques et analyse cinétique. Détermination des inhibitions mises en jeu et de leurs constantes
cinétiques (K
I
, K
i
, k
inactivation
).
Marqueurs de photo-affinité.
Intérêt pharmacologique des analogues d’état de transition, des marqueurs d'affinité, des inhibiteurs
suicide. Etudes sur des exemples.
Modification chimique de résidus essentiels : identification, inactivation.
8 - Cinétiques à 2 substrats, effet du pH sur la cinétique, identification de résidus essentiels de
protéines
Analyse cinétique avec exemples de différents mécanismes.
Effet inhibiteur par les produits.
Etude en fonction du pH : Effet sur l’activité, sur la fixation du substrat, sur l’efficacité catalytique.
9 - Problèmes d’ensemble sur enzymes impliqués dans des problématiques actuelles.
MODALITES de CONTRÔLE des CONNAISSANCES
Examen final : 60%
Contrôle continu : 40%

30 BM ST 35 STRUCTURE et INTERACTIONS des MACROMOLÉCULES BIOLOGIQUES 4 ECTS
Enseignants : C.
Etchebest, N.
Caulet, T.
De Caldas, K.
Moncoq, M.
Roué
Cours : 22 heures - TD : 18 heures
PROGRAMME des COURS
1
THERMOCHIMIE
Notions fondamentales : Système et paramètres thermodynamiques - Energie interne - Grandeurs exten-
sives et intensives liées.
Rappels des propriétés des fonctions caractéristiques d'un système thermodynamique : Energie libre F.
Entropie S - Enthalpie H et Enthalpie libre G - Potentiel chimique µ.
Evolution d'un système : Critères d'évolution - Equilibres - Réactions chimiques - Nombre de sites - K
D
.
Equation de Scatchard - Distribution d'un ligand sur n sites.
2
TECHNIQUES d’ÉTUDE des MACROMOLÉCULES
Calorimétrie : Titrage en H de K, détermination du S.
Dialyse, loi de Donnan.
Spectrométrie de masse.
Absorption optique : UV, visible.
Fluorescence : émission, excitation. Loi de Lehrer.
Activité optique : pouvoir rotatoire et dichroïsme circulaire.
3
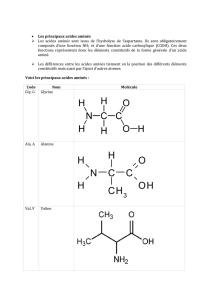
ACIDES AMINÉS et PEPTIDES
Acides aminés libres et Peptides.
Propriétés physico-chimiques : Solubilité ; ionisation et détermination du pK des acides aminés ; pouvoir
rotatoire.
Propriétés chimiques.
4
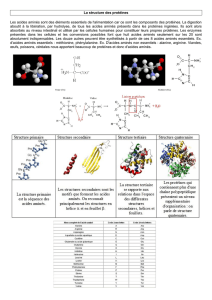
STRUCTURE des PROTÉINES
Détermination de la séquence en acides aminés : Méthodes chimiques (Edman, Gray et Hartley) et
enzymatiques, le séquenceur automatique.
Diagramme de Ramachandran.
Structures secondaires : hélices, feuillets ß, coudes.
Prédiction de structures secondaires.
Profil d'hydrophobicité (Kyte & Doolittle), moment d'amphiphilicité (Eisenberg).
Structures tertiaires : protéines globulaires et fibreuses.
Structures quaternaires.
5
ACIDES NUCLÉIQUES
Propriétés physico-chimiques des constituants.
Tautomérie des bases et ionisation des groupes phosphates, bases et sucres.
Appariement et coordonnées linéaires et angulaires.
Conformation du squelette des acides nucléiques : Diagramme de Olson et Flory.
Polymorphisme structural de l'ADN.
6
GLUCIDES
Oses : Structure linéaire et cyclique, filiation; effet anomère, propriétés chimique et principaux oses.
Dérivés d'oses.
Holosides ; principaux diholosides, méthodes d'étude ; polyosides homogènes ou mixtes ; hétérosides
7
LIPIDES et MEMBRANES BIOLOGIQUES
Les acides gras : Structure, propriétés physico-chimiques, méthodes d'analyse.
Lipides majeurs : membranaires (phospholipides, stérols, glycolipides), circulants et non membranaires.
Lipides mineurs à activité biologique spécifique (prostaglandines, leucotriènes, vitamines, hormones
stéroïdes).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%