Electrophysiologie: mécanismes et méthodes

biophysique 2013 2014 Laurent Bourdon cappaceslille.e-monsite.coM
Electrophysiologie: mécanismes
et méthodes
Activité électrique du cœur
I. Cellule cardiaque: excitabilité, conduction, automatisme et
contractilité
1.1 Anatomie et histologie cardiaque
De par leur nature histologique et leur fonction physiologique, on distingue deux types de tissus
cardiaques :
Le tissu nodal : il est constitué du nœud sinusal (1), du nœud auriculoventriculaire (2), du
tronc et des branches du faisceau de His (3) et du réseau de Purkinje (4). Son rôle essentiel
est l’élaboration et la conduction de l’influx.
Le tissu myocardique : dont la fonction principale est la contraction.
Dans les conditions physiologiques l’influx nait périodiquement du nœud sinusal de façon
automatique, sans qu’aucune intervention cérébrale ne soit nécessaire. Cet influx est conduit à
travers les oreillettes dont il provoque la contraction par des voies anatomiquement mal
individualisées.
Cet influx passe ensuite au niveau du nœud auriculoventriculaire ( ou nœud de Keith et Flack )situé à
la base des oreillettes où il subit un retard d’environ 150 ms , nécessaire à la séparation dans le
temps des contractions auriculaires et ventriculaires.
Il traverse alors la jonction auriculoventriculaire et chemine à l’intérieur du septum interventriculaire,
puis dans les parois ventriculaires en suivant le tronc, puis le faisceau de His.
Il est rapidement conduit aux cellules myocardiques ventriculaires par le réseau de Purkinje.
Dans les conditions physiologiques, l’influx ne peut passer des oreillettes aux ventricules que par le
nœud auriculoventriculaire et le tronc du faisceau de His : il existe en effet, entre les oreillettes et les
ventricules, un anneau fibreux ( 5 ) qui n’est traversé par aucune cellule myocardique ou nodale
autre que celle du tronc du faisceau de His et qui réalise ainsi l’isolation électrique nécessaire entre
oreillettes et ventricules pour que leur contraction respective puisse être décalée dans le temps.
Le rôle de conduction du tissu nodal découle d’une vitesse de conduction élevée ( 4 m/s ) par rapport
au tissu myocardique ( 0,4 m/s ), sauf au niveau du nœud auriculoventriculaire où la vitesse de
conduction, beaucoup plus lente que celle du tissu myocardique, permet la génération du retard
d’environ 150 ms
Tissu myocardique
Tissu nodal
5
3
1
2
3
3
4
3

biophysique 2013 2014 Laurent Bourdon cappaceslille.e-monsite.coM
1.2 électrophysiologie cardiaque
Comme dans le cas des cellules nerveuses, la membrane de la cellule cardiaque est polarisée et le
caractère excitable de cette cellule se traduit par l’apparition d’un potentiel d’action. Néanmoins les
cellules cardiaques possèdent leur propre spécificité.
1.2.1 potentiel de membrane des cellules cardiaques
* Les cellules myocardiques ont un potentiel de repos de – 90 mV. Le potentiel d’action d’une cellule
cardiaque possède un plateau, ce qui lui confère une durée dans le temps.
* Les cellules du faisceau de His et du réseau de Purkinje ont également un potentiel d’action en
plateau, mais elle présente la particularité d’avoir un potentiel de repos qui n’est pas stable dans le
temps : la polarisation membranaire diminue avec le temps.
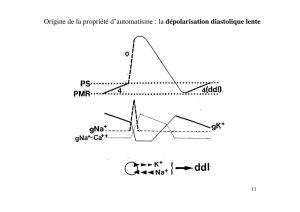
Il existe donc une dépolarisation spontanée de la cellule, caractérisée par la pente de dépolarisation
diastolique ( diastole = durée pendant laquelle le cœur est en relâchement musculaire ). Lorsqu‘elle
atteint le seuil d’excitation, cette dépolarisation engendre un potentiel d’action.
L’existence de cette pente a pour conséquences :
Cette pente est responsable de l’automatisme de la cellule
Des drogues et des stimulations nerveuses pouvant augmenter cette pente augmentent la
fréquence de l’automatisme ; inversement des drogues et des stimulations nerveuses
pouvant diminuer cette pente diminuent la fréquence de l’automatisme
* les cellules du nœud sinusal et du nœud auriculoventriculaire ont une polarisation moins
importante et présente une montée lente du potentiel d’action, rendant compte d’une vitesse de
conduction très diminuée, ce qui retarde l’influx.
La pente de dépolarisation diastolique est importante, rendant compte d’un automatisme à
fréquence élevée. Cette pente est maximale pour les cellules du nœud sinusal, ce qui explique que
ces cellules ont normalement le contrôle du rythme cardiaque.

biophysique 2013 2014 Laurent Bourdon cappaceslille.e-monsite.coM
La figure ci-dessous recense les potentiels d’action des différentes cellules cardiaques :
1.2.2 phénomènes ioniques
Comme pour les autres cellules excitables, le potentiel d’action des cellules cardiaques est dû à une
variation de la perméabilité membranaire aux différents ions.
Phase 1 : phase de dépolarisation rapide due à l’activation du canal sodique, comme dans le
cas de la fibre nerveuse
Phase 2 : phase en plateau due à l’activation plus lente d’une protéine canal laissant entrer
par diffusion les ions sodium et calcium.
Le maintien d’une perméabilité membranaire élevée au sodium explique le maintien du
potentiel à une valeur proche du potentiel d’équilibre du sodium
L’entrée du calcium par diffusion dans la cellule qui n’en contient quasiment pas est
responsable de la contraction musculaire
Phase 3 : phase de repolarisation. Cette phase correspond à une augmentation de la
perméabilité membranaire du potassium
Phase 4 : pour récupérer son état initial, la cellule doit faire sortir le sodium et le calcium
entrés pendant la phase de dépolarisation et faire entrer le potassium sorti pendant la phase
de repolarisation. Cela nécessite un transport actif de sodium, de potassium, mais aussi de
calcium.
La phase de dépolarisation diastolique des cellules du tissus nodal semble être due à une diminution
progressive de la perméabilité membranaire au potassium pendant la diastole. Le potentiel
membranaire s’adapte donc à cette variation de perméabilité.
Durant toutes les phases du potentiel d’action, la relation de Goldman est vérifiée

biophysique 2013 2014 Laurent Bourdon cappaceslille.e-monsite.coM
1.3 physiopathologie
* troubles de l’automatisme :
Il peut s’agir
D’un défaut d’automatisme ( pause sinusale )
De l’apparition d’un foyer automatique ectopique ( qui n’est pas situé à l’endroit normal,
c’est-à-dire non situé au niveau du nœud sinusal ) rentrant alors en concurrence avec le
nœud sinusal et responsable « d’extrasystoles » ou de crises de « tachycardie ».
* troubles de la conduction :
Il peut s’agir :
D’un défaut de conduction des voies normales de conduction ( par exemple : du tronc ou des
branches du faisceau de His ), responsable de blocs auriculoventriculaires ( BAV )
De l’existence d’une voie anormale de conduction ( par exemple : le faisceau de Kent,
constitué de cellules myocardiques qui relient l’oreillette et le ventricule, court-circuite le
nœud auriculoventriculaire sans provoquer le retard physiologique de 0,15 s [syndrome de
Wolff-Parkinson-White] ). Cette voie anormale est responsable d’une dépolarisation
prématurée du ventricule.
* troubles de l’excitabilité :
De façon physiologique, la cellule devient de moins en moins excitable lors de la phase 4 de
dépolarisation diastolique.
* phénomène de réentrée :
Entre deux points, existent deux voies de conduction, non nécessairement anatomiquement
distinctes, mais fonctionnellement distinguables par la durée de leur période réfractaire. Un influx
arrive précocément, par rapport à l’influx précédent, à l’origine de ces deux voies en période
réfractaire pour l’une voie, et non pour l’autre. Le démarrage d’un cycle de tachycardie par réentrée
est alors possible.
B A B A B A
L’influx descendant arrive à
l’instant où la voie B est
réfractaire et non la voie A.
l’influx est transmis aux
ventricules uniquement par la
voie A.
La voie B sort de sa période
réfractaire lorsque l’influx
venant de A l’atteint par voie
rétrograde
L’influx ayant traversé B se
retransmet à nouveau aux deux
ventricules par la voie A.

biophysique 2013 2014 Laurent Bourdon cappaceslille.e-monsite.coM
1.4 pharmacologie et traitement
Les troubles de l’automatisme peuvent être prévenus par des drogues agissant sur la pente de
dépolarisation diastolique.
Les troubles de la conduction peuvent être modifiés par des médicaments agissant sur la vitesse de la
phase de dépolarisation rapide ( phase 0 ) ou sur la durée de période réfractaire.
Ainsi, en augmentant la période réfractaire de l’une des deux voies d’un circuit de réentrée, on peut
bloquer le cycle responsable de la tachycardie.
Les médicaments arythmiques, répartis en différentes classes, agissent plus ou moins sélectivement
sur l’une des phases membranaires :
L’inhibition du canal sodique rapide ( phase 0 ) par les médicaments « quinidine-like »
entraînant un ralentissement de la conduction, en agissant sur la pente de dépolarisation
rapide.
L’inhibition du courant lent calcicosodique ( phase 2 ) par les médicaments appelés
« inhibiteurs calciques » déprime l’excitabilité et la conduction des fibres à réponse lente. La
diminution intramyocardique du calcium entraîne également une dépression de la
contractibilité, expliquant le fait que ce médicament est contre indiqué dans l’insuffisance
cardiaque
Les béta bloquants diminuent la pente de dépolarisation diastolique
Lorsque les drogues sont inactives, l’implantation d’un stimulateur cardiaque intracorporel
( pacemaker ) peut devenir nécessaire. Celui-ci est un boitier relié au cœur par une sonde et délivrant
une impulsion de stimulation lorsqu’il ne détecte aucune stimulation spontanée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%