Télécharger cette fiche au format PDF

Progrès
en
urologie
(2016)
26,
121—128
Disponible
en
ligne
sur
ScienceDirect
www.sciencedirect.com
REVUE
DE
LA
LITTÉRATURE
Données
comparatives
moléculaires,
précliniques
et
cliniques
des
différentes
souches
de
bacille
de
Calmette-Guérin
(BCG)
:
revue
de
la
littérature
du
Comité
de
cancérologie
de
l’Association
franc¸aise
d’urologie
(CCAFU)
Molecular,
preclinical,
and
clinical
comparative
data
regarding
different
strains
of
bacillus
Calmette-Guérin
(BCG):
Review
by
the
French
Urological
Association
Oncology
Committee
(CCAFU)
Y.
Neuzilleta,∗,
F.
Dubosqb,c,
E.
Xylinasd,
P.
Coline,
E.
Comperatf,
N.
Houedeg,
S.
Larreh,
A.
Masson-Lecomtei,
G.
Pignotj,
P.
Puechk,
M.
Roumiguiel,
A.
Mejeanm,
M.
Roupretn
aService
d’urologie,
hôpital
Foch,
université
Versailles
—
Saint-Quentin-en-Yvelines,
40,
rue
Worth,
92150
Suresnes,
France
bService
d’urologie,
clinique
de
Meudon,
92360
Meudon,
France
cClinique
de
l’Alma,
75007
Paris,
France
dService
d’urologie,
hôpital
Cochin,
université
Paris
Descartes,
75679
Paris,
France
eService
d’urologie,
hôpital
privé
de
la
Louvière,
générale
de
santé,
59000
Lille,
France
fService
d’anatomopathologie,
groupe
hospitalier
de
la
Pitié-Salpêtrière,
université
Pierre-et-Marie-Curie,
75013
Paris,
France
gService
d’oncologie
médicale,
CHU
de
Nîmes,
30000
Nîmes,
France
hService
d’urologie,
CHU
de
Reims,
51000
Reims,
France
iService
d’urologie,
hôpital
Henri-Mondor,
université
Paris-Est,
94010
Créteil,
France
jService
d’urologie,
hôpital
Bicêtre,
université
Paris-Sud,
94270
Le
Kremlin-Bicêtre,
France
kService
de
radiologie,
CHRU
de
Lille,
59037
Lille,
France
lService
d’urologie,
CHU
Rangueil,
31400
Toulouse,
France
∗Auteur
correspondant.
Adresse
e-mail
:
(Y.
Neuzillet).
http://dx.doi.org/10.1016/j.purol.2015.10.011
1166-7087/©
2015
Elsevier
Masson
SAS.
Tous
droits
réservés.

122
Y.
Neuzillet
et
al.
mService
d’urologie,
hôpital
européen
Georges-Pompidou,
université
Paris
Descartes,
75015
Paris,
France
nService
d’urologie,
groupe
hospitalier
de
la
Pitié-Salpêtrière,
université
Pierre-et-Marie-Curie,
75013
Paris,
France
Rec¸u
le
3
septembre
2015
;
accepté
le
30
octobre
2015
Disponible
sur
Internet
le
27
novembre
2015
MOTS
CLÉS
BCG
;
Vessie
;
Souche
;
Génome
;
Cytotoxicité
;
Réaction
immunitaire
;
Efficacité
;
Tolérance
Résumé
Objectif.
—
Rapporter
les
différences
existantes
entre
les
différentes
souches
de
BCG
utili-
sées
pour
le
traitement
des
tumeurs
de
la
vessie
n’infiltrant
pas
le
muscle
(TVNIM)
sur
le
plan
moléculaire,
de
la
cytotoxicité,
de
l’immunogénicité,
de
l’efficacité
clinique
et
de
la
tolérance.
Matériel
et
méthode.
—
Une
recherche
bibliographique
a
été
conduite
à
partir
de
la
base
de
données
bibliographiques
MedLine
à
partir
des
mots
clés
suivants
:
BCG
;
vessie
;
souche
;
génome
;
cytotoxicité
;
réaction
immunitaire
;
efficacité
;
tolérance.
Résultats.
—
Des
différences
génétiques
entre
les
souches
de
BCG
ont
été
mises
en
évidence
et
corrélées
à
leur
délai
de
différenciation
depuis
leur
mise
en
culture
initiale,
présumant
d’une
moindre
résistance
aux
défenses
immunitaires
de
l’hôte
des
souches
Tice
et
danoise
vis-à-vis
de
la
souche
Connaught.
Les
données
comparatives
précliniques
ont
montré
un
effet
cytotoxique
et
une
immunogénicité
supérieure
de
la
souche
Connaught
par
rapport
aux
souches
Tice
et
danoise.
Les
études
de
phase
III
ont
montré
une
efficacité
supérieure
du
BCG
Connaught
vis-à-vis
du
BCG
Tice
et
du
BCG
danois
vis-à-vis
du
BCG
Tice
en
termes
de
survie
sans
récidive.
Conclusions.
—Parmi
les
souches
de
BCG
utilisées
en
France
pour
le
traitement
des
TVNIM,
l’efficacité
préclinique
et
clinique
de
la
souche
Connaught
a
été
supérieure
à
celle
de
la
souche
Tice.
La
limite
des
études
actuellement
disponibles
réside
principalement
dans
l’absence
d’utilisation
d’un
traitement
d’entretien.
©
2015
Elsevier
Masson
SAS.
Tous
droits
réservés.
KEYWORDS
BCG;
Bladder;
Strain;
Genome;
Cytotoxicity;
Immune
response;
Efficiency;
Safety
Summary
Objective.
—
To
review
the
differences
between
the
BCG
strains
used
for
the
treatment
of
non-muscle
invasive
bladder
cancer
(NMIBC)
at
the
molecular
level,
regarding
cytotoxicity,
immunogenicity,
clinical
efficiency,
and
safety.
Material
and
method.
—
A
systematic
review
of
the
literature
search
was
performed
from
the
database
MedLine,
focused
on
the
following
keywords:
BCG;
bladder;
strain;
genome;
cytotoxi-
city;
immune
response;
efficiency;
safety.
Results.
—
Genetic
differences
between
BCG
strains
have
been
identified
and
correlated
to
their
time
to
differentiation
from
their
initial
cultures
start,
assuming
a
lower
resistance
to
the
host
immune
defenses
of
Tice
and
Danish
strains
compared
to
the
Connaught
strain.
Preclinical
comparative
data
showed
superior
cytotoxic
effect
and
immunogenicity
of
the
Connaught
strain
compared
to
Tice
and
Danish
strains.
The
phase
III
trials
have
shown
superior
efficiency
of
BCG
Connaught
compared
to
BCG
Tice
and
BCG
Danish
compared
to
BCG
Tice
regarding
recurrence-
free
survival.
Conclusions.
—
Among
BCG
strains
used
in
France
in
NMIBC
treatment,
preclinical
and
clinical
efficiency
of
Connaught
strain
was
higher
than
that
of
the
Tice
strain.
The
limits
of
the
currently
available
studies
lie
primarily
in
the
lack
of
use
of
maintenance
therapy.
©
2015
Elsevier
Masson
SAS.
All
rights
reserved.
Introduction
En
1902,
Edmond
Nocard,
vétérinaire
et
microbiologiste
franc¸ais,
a
fourni
à
ses
compatriotes
Albert
Calmette
et
Camille
Guérin,
respectivement
médecin
bactériologiste
et
vétérinaire
biologiste,
une
culture
de
Mycobacterium
bovis
isolée
d’une
vache
tuberculeuse.
Dix
ans
plus
tard,
après
96
mises
en
culture
successives
sur
des
tranches
de
pommes
de
terre
glycérinées
et
immergées
dans
de
la
bile
de
bœuf
stérile,
la
souche
bactérienne
partiellement
atténuée
devint
non
pathogène
pour
l’homme
et
fut
nommé
bacille
de
Cal-
mette
et
Guérin
(BCG)
[1].
La
méthode
de
culture
utilisée

Comparaison
des
souches
de
BCG
123
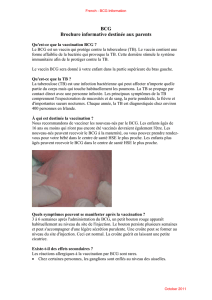
Figure
1.
Généalogie
des
souches
de
BCG.
Le
schéma
montre
la
position
des
marqueurs
génétiques
identifiés
dans
l’étude
de
Brosch
et
al.
[2],
les
marqueurs
de
région
de
différence
(RD),
certaines
suppressions
spécifiques
aux
souches
et
la
distribution
des
souches
dans
les
quatre
groupes
de
DU2.
a
conduit
à
sélectionner
des
bactéries
ayant
une
régula-
tion
de
leur
génome
favorisant
l’expression
de
gênes
de
protéines
impliquées
dans
le
métabolisme
du
glycérol
et
réprimant
ceux
des
protéines
responsables
de
la
virulence
[2].
À
partir
de
1921,
la
souche
de
BCG
a
été
distribuée
aux
laboratoires
qui
en
faisaient
la
demande.
Dans
cha-
cun
de
ces
laboratoires,
la
souche
a
été
cultivée
dans
des
milieux
de
culture
différents,
conduisant
à
des
pressions
de
sélection
différentes
et
ainsi
à
des
adaptations
géné-
tiques
différentes
des
bactéries
dans
chaque
laboratoire
[3].
Tableau
1
Définition
des
groupes
à
risque
évolutif
de
récidive
et
progression
des
TVNIM
[7].
Risque
évolutif
Caractéristiques
tumorales
Traitement
adjuvant
Faible
Premier
diagnostic
et
Ta
et
bas
grade
ou
low
malignancy
potential
(LMP)
(grade
1)
et
unique
et
diamètre
<
3
cm
Surveillance
simple
Intermédiaire
Ta
bas
grade
ou
LMP
(grade
1—2)
multifocale
et/ou
récidivante,
T1
bas
grade
(grade
1—2)
Instillations
hebdomadaires
de
mitomycine
C
(MMC)
sur
6—8
semaines
consécutives
après
cicatrisation
vésicale
(4
à
6
semaines)
Le
BCG
peut
être
discuté
en
alternative
aux
instillations
de
MMC
de
première
intention
ou
en
cas
d’échec
du
traitement
par
la
mitomycine
Élevé
Haut
grade
(grade
3)
(quel
que
soit
le
stade)
ou
T1
récidivante
ou
carcinome
in
situ
Seconde
RTUV,
puis
instillations
endovésicales
de
BCG
(sauf
contre-indications)
après
cicatrisation
vésicale
(4
à
6
semaines)
Si
les
instillations
de
BCG
sont
bien
supportées,
intérêt
d’un
traitement
d’entretien
En
cas
d’échec
du
traitement
par
BCG,
la
cystectomie
totale
demeure
le
traitement
de
choix
Après
la
RTUV,
une
cystectomie
d’emblée
peut
être
discutée
en
RCP
dans
certaines
formes
de
mauvais
pronostic
chez
des
patients
jeunes

124
Y.
Neuzillet
et
al.
De
ce
fait,
les
diverses
souches
de
BCG
cultivées
dans
le
monde
se
sont
génétiquement
différenciées
(Fig.
1)
:
soit
précocement
(dénommées
«
souches
anciennes
»),
parmi
lesquelles
la
souche
japonaise
(BCG
Tokyo)
utilisée
au
Japon
pour
les
instillations
endovésicales
;
soit
ultérieurement
(dénommées
«
souches
intermédiaires
»)
;
soit
tardivement
(dénommées
«
souches
récentes
»),
parmi
lesquelles
les
souches
RIVM
du
Médac®(Medac
GmbH,
Wedel,
Allemagne),
Tice
de
l’Oncotice®(Merck,
Kenilworth,
NJ,
États-Unis)
et
Connaught
de
l’Immucyst®(Sanofi
Pasteur,
Lyon,
France)
[4].
À
partir
de
1960,
la
technique
de
culture
de
produc-
tion
a
été
révolutionnée
par
l’usage
de
la
lyophilisation
qui
a
permis
de
réduire
drastiquement
le
nombre
de
mises
en
culture
successives
(ou
«
repiquages
»),
sources
de
variations
génétiques
[5].
Ce
changement
a
abouti
à
une
stabilisa-
tion
du
génome
des
différentes
souches,
telles
qu’elles
sont
actuellement
commercialisées.
Les
techniques
de
produc-
tion
actuelles
assurent
et
contrôlent
la
stabilité
du
génome
[6].
Initialement
développé
dans
un
but
vaccinal
contre
la
tuberculose,
le
BCG
a
été
utilisé
pour
la
première
fois
en
thé-
rapeutique
humaine
antitumorale
par
Mathé
en
1969
[7].
En
1974,
Zbar
a
démontré
l’effet
antitumoral
du
BCG
adminis-
tré
localement
sur
l’hépatocarcinome
du
cobaye
et
a
défini
les
règles
de
l’immunothérapie
locale.
En
1975,
Bloomberg
a
démontré
la
bonne
tolérance
des
instillations
endovési-
cales
de
BCG
chez
le
chien.
L’ensemble
de
ces
observations
ont
conduit
Morales,
puis
Martinez-Pineiro,
à
utiliser,
dès
1976,
le
BCG
en
instillations
locales
dans
le
traitement
prophylactique
des
tumeurs
de
la
vessie
n’infiltrant
pas
le
muscle
(TVNIM)
[7].
Au
regard
de
l’hétérogénéité
géné-
tique
des
souches
disponibles
de
BCG
pour
le
traitement
adjuvant
à
la
résection
transurétrale
des
tumeurs
de
vessie
(RTUV)
des
TVNIM
(indication
rappelée
dans
le
Tableau
1)
[8,9],
l’objectif
de
cette
revue
de
la
littérature
était
de
définir
les
différences
moléculaires
entre
les
différentes
souches
utilisées
en
France
(RIVM,
Tice
et
Connaught)
et
leurs
conséquences
sur
le
plan
préclinique
et
clinique
en
termes
d’efficacité
et
de
tolérance.
Matériel
et
méthode
Les
données
sur
les
souches
de
BCG
ont
été
explorées
dans
MedLine
(http://www.ncbi.nlm.nih.gov)
en
utilisant
les
mots
clés
MeSH
suivants
ou
une
combinaison
de
ces
mots-
clés
:
BCG
;
vessie
;
souche
;
génome
;
cytotoxicité
;
réaction
immunitaire
;
efficacité
;
tolérance.
Les
articles
obtenus
ont
ensuite
été
sélectionnés
en
fonction
de
la
combinaison
des
éléments
suivants
:
•méthodologie
:
les
études
hors
sujet
ont
été
exclues
d’emblée.
Parmi
les
articles
éligibles,
seules
les
études
comparatives
ont
été
sélectionnées.
Le
caractère
pros-
pectif
ou
rétrospectif
du
recueil
des
données
n’était
pas
un
critère
de
sélection
;
•langue
de
publication
:
anglais/franc¸ais
;
•pertinence
par
rapport
au
sujet
traité
:
les
études
compa-
ratives
des
données
génétiques,
moléculaires
et
de
cytotoxicité
in
vitro
ont
toutes
été
prises
en
compte.
L’analyse
des
études
comparatives
des
données
sur
l’induction
d’une
réaction
immunitaire
et
l’efficacité
cli-
nique
a
été
restreinte
à
celles
concernant
les
souches
de
BCG
utilisées
pour
les
instillations
endovésicales
(exclusion
des
études
concernant
la
vaccination
anti-
tuberculeuse)
;
•date
de
publication
:
de
1985,
à
ce
jour
(30
dernières
années).
Ainsi,
265
articles
ont
été
revus
et
27
ont
été
sélectionnés
(Fig.
2).
Résultats
Différences
moléculaires
entre
les
souches
de
BCG
L’analyse
génomique
comparative
des
différentes
souches
de
BCG
a
mis
en
évidence
des
variations
à
type
de
délé-
tion
et
d’insertion
[2].
L’atténuation
de
la
virulence
du
BCG
comparativement
à
M.
bovis
est
liée
à
la
perte
du
gène
de
la
protéine
ESX-1,
du
fait
de
la
délétion
nommée
RD1.
Néanmoins,
la
perte
d’ESX-1
n’est
pas
seule
responsable
de
l’atténuation
de
la
virulence.
En
effet,
la
réintroduction
de
RD1
dans
les
lignées
de
BCG
n’a
pas
abouti
à
la
récupéra-
tion
d’une
virulence
complète,
ce
qui
témoigne
du
caractère
multifactoriel
de
l’atténuation
de
virulence
du
BCG
vis-à-vis
de
M.
bovis
[10].
En
dépit
de
cette
délétion,
le
génome
du
BCG
contient
davantage
de
bases
nucléotidiques
que
celui
de
M.
bovis
en
raison
de
la
duplication
en
tandem
de
deux
régions,
nommées
«
DU1
»
et
«
DU2
»
[11].
La
duplication
de
«
DU1
»
n’est
observée
que
dans
la
souche
BCG
Pasteur
utili-
sée
en
vaccination
contre
la
tuberculose.
La
duplication
de
«
DU2
»
est
commune
à
toutes
les
autres
souches
dérivées
du
BCG
distribué
en
1921,
mais
a
subi
des
polymorphismes
génétiques
[2].
Ainsi,
dans
les
souches
anciennes
(souches
japonaise),
intermédiaires,
et
tardives
(souches
RIVM
du
Médac®,
Tice
de
l’Oncotice®et
Connaught
de
l’Immucyst®),
les
régions
DU2
sont
différentes
(Fig.
1).
Le
DU2
de
groupe
III,
qui
caractérise
les
souches
intermédiaires,
présente
une
délétion
de
10
paires
de
bases
au
codon
91
du
gène
phoR,
entraînant
son
inactivation.
La
perturbation
du
métabolisme
du
phosphate
qui
en
résulte
a
constitué
un
désavantage
pour
la
croissance
bactérienne
in
vivo
[12].
L’analyse
comparative
des
polymorphismes
nucléoti-
diques
des
souches
de
BCG
utilisées
pour
les
instillations
endovésicales
a
été
étudiée
pour
les
souches
Tice
et
Connaught
[13].
L’étude
a
montré
que
la
souche
Tice
à
trois
polymorphismes
spécifiques,
deux
sur
des
protéines
de
fonc-
tion
inconnue
et
un
concernant
le
gène
sodC,
codant
une
enzyme
impliquée
dans
la
défense
contre
le
stress
oxyda-
tif.
Le
polymorphisme
présent
dans
le
génome
de
la
souche
Tice
est
responsable
de
la
perte
de
cette
activité
enzyma-
tique,
ce
qui
réduit
la
résistance
du
BCG
au
mécanisme
de
défense
immunitaire
innée
de
l’hôte
et
ainsi
la
durée
de
vie
du
BCG
chez
le
patient
traité
et
donc,
potentiellement,
son
efficacité
[14].
Par
ailleurs,
la
structure
des
polysaccharides
membra-
naires
des
BCG
de
souches
Tice,
Connaught
et
Pasteur,
responsables
d’un
effet
cytotoxique
direct,
a
été
compa-
rée
[15].
L’analyse
a
montré
une
similitude
pour
les
trois
souches.
À
notre
connaissance,
aucune
analyse
comparative
du
même
type
n’a
étudié
la
souche
RIVM.
Au
total,
les
différences
moléculaires
entre
les
diffé-
rentes
souches
de
BCG
sont
les
conséquences
de
différences

Comparaison
des
souches
de
BCG
125
Figure
2.
Arbre
décisionnel
pour
la
sélection
des
articles.
génomiques.
À
ce
jour,
les
données
comparatives
entre
les
souches
RIVM,
Tice
et
Connaught,
suggèrent
qu’il
existe
une
résistance
aux
mécanismes
de
défense
immunitaire
innée
de
l’hôte
moins
efficace
pour
la
souche
Tice.
Différences
de
cytotoxicité
induite
par
les
différentes
souches
de
BCG
in
vitro
À
ce
jour,
trois
publications
ont
rapporté
l’étude
compara-
tive
de
l’activité
antitumorale
directe
de
souches
de
BCG
sur
des
lignées
cellulaires
de
carcinome
urothélial
vésical
[16—18].
Rajala
et
al.
ont
comparé
la
cytotoxicité
sur
la
lignée
cellulaire
T24
(dérivée
de
cellules
d’une
TVNIM
de
haut
grade)
de
5
souches
:
1
intermédiaires
(i.e.
porteuse
d’un
DU2
de
groupe
III)
Glaxo-Evans
et
4
tardives
(DU2
de
groupe
IV)
RIVM,
Pasteur,
Tice
et
Connaught
[16].
L’activité
cytotoxique
du
BCG
Connaught
était
supérieure
à
celle
du
BCG
Tice.
Les
autres
différences
observées
n’étaient
pas
sta-
tistiquement
significatives.
Schwarzer
et
al.
ont
comparé
la
cytotoxicité
sur
les
lignées
cellulaires
T24
et
Cal29
(dérivée
de
cellules
d’une
tumeur
infiltrant
le
muscle
métastatique)
de
la
souche
S4-Jena,
de
différenciation
précoce
(DU2
du
groupe
II)
avec
la
souche
Tice,
de
différenciation
tardive
[17].
L’activité
cytotoxique
du
BCG
S4-Jena
était
supérieure
à
celle
du
BCG
Tice
sur
la
lignée
Cal29
et
comparable
sur
la
lignée
T24.
Plus
récemment,
Secanella-Fandos
et
al.
ont
comparé
l’effet
inhibiteur
de
la
prolifération
cellulaire
sur
des
lignées
cellulaires
T24,
J82
et
RT4
(ces
deux
dernières
étant
dérivées
de
cellules
d’une
tumeur
infiltrant
le
muscle
non
métastatique,
histologiquement
peu
différenciée
pour
J82
et
bien
différenciée
pour
RT4),
de
8
souches
:
3
précoces,
Japonnaise,
Russe
et
Moreau
;
2
intermédiaires,
danoise
et
Glaxo-Evans
;
et
3
tardives,
Tice,
Connaught
et
Phipps
[18].
L’inhibition
de
la
prolifération
de
cellules
J82
par
le
BCG
Connaught
a
été
supérieure
à
celle
liée
au
BCG
Tice
et
l’inhibition
de
la
prolifération
de
cellules
RT4
par
le
BCG
Connaught
a
été
supérieure
à
celle
liée
à
la
souche
danoise.
En
pratique
clinique,
le
temps
de
contact
recommandé
entre
le
BCG
et
l’urothélium
est
de
2
heures
[9].
Dans
les
études
in
vitro
mentionnés,
à
l’exception
de
celle
de
Secanella-Fandos
et
al.
(3
heures
de
contact
entre
le
BCG
et
les
cellules),
la
durée
de
contact
a
été
plus
longue
(1
jour
dans
l’étude
de
Schwarzer
et
al.
et
entre
2
et
5
jours
dans
celle
de
Rajala
et
al.).
Cette
différence
de
temps
de
contact
entre
les
conditions
expérimentales
in
vitro
et
celles
utili-
sées
en
pratique
clinique
doit
être
prise
en
compte
dans
l’interprétation
des
résultats.
Au
total,
il
existe
des
différences
de
cytotoxicité
entre
les
différentes
souches
de
BCG.
Le
type
de
DU2
des
souches
n’a
pas
été
corrélé
à
leur
effet
cytotoxique.
Les
données
comparatives
entre
les
souches
RIVM,
Tice
et
Connaught
ont
montré
une
cytotoxicité
supérieure
de
la
souche
Connaught
par
rapport
aux
souches
Tice
et
RIVM.
Différences
de
capacité
à
induire
une
réaction
immunitaire
entre
les
différentes
souches
de
BCG
La
production
d’IL6
et
d’IL8
oriente
la
réponse
immunitaire
vers
une
réaction
de
type
cellulaire
TH1
qui
met
en
jeu
les
phénomènes
de
cytotoxicité
impliqués
dans
le
méca-
nisme
d’action
de
la
BCG-thérapie
[19].
Les
phénomènes
de
cytotoxicité
ont
pour
support
les
lymphocytes
T
CD8+
spécifiques
des
antigènes
mycobactériens
à
l’origine
de
la
réaction
TH1
[20]
et
les
lymphocytes
T
natural
killer
[21].
Secanella-Fandos
et
al.
ont
comparé
la
capacité
à
 6
6
 7
7
 8
8
1
/
8
100%