Chapitre 6 I. La digestion enzymatique des glucides alimentaires 3

Chapitre 6
I. La digestion enzymatique des glucides alimentaires
3) Les propriétés fondamentales des enzymes
● les enzymes sont des biocatalyseurs
Document 3 page 167
L’hydrolyse spontanée de l’amidon est possible mais elle est très lente : on observe l’apparition de sucres
réducteurs au bout d’une semaine si on place de l’empois d’amidon à 37°C.
L’hydrolyse de l’amidon est beaucoup plus rapide en présence d’amylase ou d’acide chlorhydrique : HCl.
Ces deux molécules sont des catalyseurs :
- elles accélèrent considérablement la vitesse de la réaction
- elles agissent à faible concentration
- elles se retrouvent intactes à la fin de la réaction
L’hydrolyse avec HCl ne se produit qu’à 100°C : HCl n’est pas un catalyseur biologique.
L’hydrolyse avec l’amylase se produit à 35°C (et est terminée au bout de 15 minutes) : l’amylase est un
catalyseur biologique.
● les enzymes ont une double spécificité
Une enzyme ne transforme qu’une molécule ou un petit nombre de molécules voisines qui constituent
son substrat : c’est la spécificité de substrat
Sur son substrat une enzyme ne catalyse qu’un seul type de réaction chimique : c’est la spécificité de
réaction.
La double spécificité sert à nommer les enzymes en ajoutant le suffixe –ase :
- la spécificité de réaction : sert à nommer les grands groupes d’enzymes (hydrolases, synthétases, oxydo-
réductases …)
- la spécificité de substrat : sert à donner le nom de chaque enzyme (amylase, saccharase…).
- la combinaison des deux spécificités est actuellement utilisée pour nommer les enzymes nouvellement
découvertes (ribulose-di-phosphate carboxylase)
- certaines enzymes connues depuis longtemps échappent à la nomenclature (pepsine, lysozyme)
II. LE MECANISME MOLECULAIRE DE L’ACTIVITE DES ENZYMES
TP17 Etude de la structure moléculaire et du fonctionnement d’une enzyme
1) La structure des enzymes
Document 1 page 168 : amylase
Les enzymes sont des protéines : chaînes constituées par l’assemblage d’au moins 50 acides aminés.
(Les molécules comportant moins de 50 acides aminés sont appelées peptides.)
Les enzymes, comme toutes les protéines, possèdent une structure tridimensionnelle maintenue par des
liaisons hydrogène et pour certaines par des ponts disulfures qui sont des liaisons covalentes entres 2
acides aminés contenant du soufre.
L’activité d’une enzyme nécessite la conservation de sa forme.
Documents 2 et 3 page 169 : amylase
Les enzymes ont une forme qui apparaît souvent quelconque, globuleuse et irrégulière, mais elles
possèdent toujours une zone en creux en forme de cuvette ou de gouttière appelée : site actif.
Le site actif comporte deux types d’acides aminés qui ont des fonctions différentes :
● les acides aminés de liaison (de fixation) : constituent une zone de forme complémentaire de celle d’une
partie du substrat. Ils sont responsables de la spécificité de substrat.
● les acides aminés catalytiques : assurent la réalisation de la réaction car ils sont capables d’agir sur le
substrat. Ils sont responsables de la spécificité de réaction.

2) Les étapes de la catalyse enzymatique
http://pedagogie.ac toulouse.fr/svt/serveur/lycee/gutjahr/molec3D/molec3d/dossiers/carboxyp_accueil.htm
La durée d’une réaction enzymatique est de l’ordre de la milliseconde, on peut néanmoins distinguer
3 étapes :
● la formation d’un complexe enzyme-substrat par fixation du substrat dans le site actif grâce aux
acides aminés de liaison
● la transformation du substrat en produit (s) grâce aux acides aminés catalytiques
● la dissociation du complexe et la libération du ou des produits de la réaction.
Schémas simplifiés : page 177
III. L’INFLUENCE DU MILIEU SUR LA CATALYSE ENZYMATIQUE
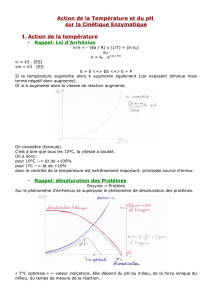
1) L’action de la température
Exercice 3 page 178
A 0°C, la vitesse de la réaction est très faible, voire nulle.
Les enzymes sont inactives mais retrouvent leur activité à température plus élevée : elles sont inhibées
par le froid.
Cette inhibition est due à la faible agitation des molécules à basse température qui diminue les probabilités de
rencontre entre l’enzyme et le substrat.
La vitesse de la réaction augmente avec la température jusqu’à une vitesse maximale atteinte
généralement vers 40°C et qui constitue la température optimale.
Au-delà de 50°C, la vitesse de la réaction chute brutalement et devient nulle vers 60°C.
L’enzyme ne retrouve pas son activité à température plus basse : elle est détruite.
La chaleur provoque la rupture des liaisons hydrogène, la forme de l’enzyme est modifiée et en particulier
celle de son site actif.
2) L’action du pH
Chaque enzyme agit avec un maximum d’efficacité pour un pH précis appelé pH optimum.
Les pH optimum sont très variables selon les enzymes : pH optimum = 7 pour l’amylase, pH optimum = 2
pour la pepsine responsable de l’hydrolyse des protéines dans l’estomac.
Lorsque l’enzyme est placée à un pH plus bas ou plus élevé, la vitesse de la réaction diminue très
rapidement puis devient nulle.

La diminution de vitesse est due à une modification de l’état d’ionisation des acides aminés du site actif
dont le fonctionnement est modifié (perturbation de la fixation du substrat ou de l’activité catalytique).
Pour des valeurs plus éloignées du pH optimum, il peut y avoir une modification irréversible de la forme de
l’enzyme.
3) L’action des inhibiteurs chimiques
Ce sont des molécules qui ont une forme proche de celle du substrat.
Elles peuvent se fixer dans le site actif de l’enzyme mais elles ne sont pas transformées.
Elles diminuent la vitesse initiale de la réaction pour les faibles concentrations en substrat mais elles ne
modifient pas la vitesse maximale de la réaction pour les fortes concentrations en substrat car il y a une
compétition entre le substrat et l’inhibiteur pour la fixation dans le site actif de l’enzyme.
Grâce à l’activité de certaines enzymes digestives, les macromolécules de glucides présentes dans les
aliments sont progressivement transformées en glucose.
Toutes les enzymes digestives sont des hydrolases : elles catalysent toutes des réactions d’hydrolyse.
Il existe de nombreuses autres catégories d’enzymes nécessaires à la réalisation de toutes les réactions
du métabolisme.
1
/
3
100%