Version imprimable en pdf

Action de la Température et du pH
sur la Cinétique Enzymatique
1. Action de la température
•Rappel: Loi d'Arrhénius
ln k = - (Ea / R) x (1/T) + (ln k0)
ou
k = k0 . e(-Ea / RT)
vi = k3 . [ES]
vm = k3 . [E]t
E + S <=> ES <=> E + P
Si la température augmente alors k augmente également (car exposant diminue mais
terme négatif donc augmente).
Or si k augmente alors la vitesse de réaction augmente.
On considère (formule)
C'est à dire que tous les 10°C, la vitesse a doublé.
On a donc:
pour 10°C --> Δt de +100%
pour 1°C --> Δt de +10%
donc le contrôle de la température est extrêmement important: principale source d'erreur.
•Rappel: dénaturation des Protéines
Enzyme = Protéine
Sur le phénomène d'Arrhénius se superpose le phénomène de dénaturation des protéines.
« T°C optimale » = valeur indicatrice. Elle dépend du pH du milieu, de la force ionique du
milieu, du temps de mesure de la réaction.

--> mesure de Vm à 60°C, méthode des deux points(30sec d'écart).
On note que pour de petites enzymes de 10 à 20KDa, on a des températures optimales
élevées (80 à 100°C). Par contre pour les enzymes à structure complexe de 100 à 500KDa,
on a des températures optimales faibles (40 à 50°C).
Certains micro-organisme thermophiles ont des enzymes au températures optimales
comprises entre 70 et 90°C. Ceci est d'intérêt industriel notamment pour les industries du
génie protéique où l'on recherche des enzymes thermorésistantes.
2. Influence du pH sur l'activité
•pH extrêmes
--> très acides: dénaturation et précipitation
--> très alcalin : dénaturation sans précipitation
•Autres pH
Le pH agit sur les groupement ionisables des protéines. Notamment des groupements des
chaînes latérales -COOH où le pKA ~ 4 pour les Acides aspartique / glutamique.
Également sur les groupements amines des chaînes latérales des acides aminés où le pKA
~ 6 pour l'immidazol, l'histidine.
Au pH optimum, l'activité est maximale.
Pour la plus part des enzymes, le pH optimal se situe entre 6 et 8, il s'agit du pH optimal
qd 2 groupes sont ionisés.
Enzyme optimum à pH 2-3 acide: la pepsine; enzyme optimum à pH 10 alcalin: la
phosphatase alcaline.

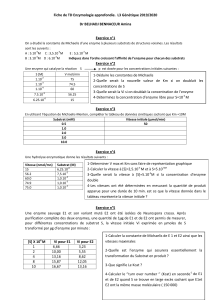
Application:
Il faut mesurer Vm à pH optimum.
1
Ex: Lactate + NAD+ <=> Pyruvate + NADH + H+
2
pH optimum = 7
R1 --> pH 8 R1 pH 8 diminue [H+] donc favorise le sens 1
R2 --> pH 6 R2 pH 6 augmente [H+] donc favorise le sens 2
Si on inactive l'enzyme vie un réactif d'arrêt alors on s'éloigne du pH otpimum.
Les effets du pH peuvent se voir au niveau de l'enzyme: modification de l'ionisation d'un
groupement fonctionnel de l'enzyme; modification de la structure de la protéine;
modification du site de fixation du substrat; modification de la catalyse.
Dès qu'il y a une modification de la fixation du substrat sur l'enzyme alors il y a
modification du Km car il reflète l'affinité de l'enzyme pour son substrat.
L'effet du pH peut également se voir au niveau du substrat: on obtient un substrat
ionisable avec un des formes se fixatn sur l'enzyme.
Modèle simple de l'effet du pH:
•ionisation de l'enzyme:
On a donc
[EH]T = [EH] + [EHS] + [E-] + [EH2+]
•ionisation du substrat:
ex: Substrat non protoné se fixant à l'enzyme
SH <=> S- + H+
SH+ <=> S + H+
1
/
3
100%