Naissances prématurées

Naissances prématurées
Rôles de l’inflammation et du polymorphisme génétique
Les mises bas prématurées demeurent la cause de morbidité périnatale et de
mortinatalité la plus fréquente. Leur prévention est impossible du fait de l’absence des
connaissances physiopathologiques expliquant leur pathogénie et de l’inexistence d’outils
diagnostiques prédictifs et de thérapeutiques.
Cependant, les études cliniques, épidémiologiques et expérimentales ont montré que
les infections génitales jouaient un rôle important dans l’étiologie de ces naissances
prématurées.
La prématurité reste le problème central de la médecine néonatale. Les complications
de la prématurité sont les hémorragies cérébrales et les dommages cérébraux que celles-ci
provoquent (leucomalacie péri-ventriculaire et paralysie cérébrale spastique) et la dysplasie
broncho-pulmonaire.
Dernièrement on a démontré que le risque pour le nouveau-né de présenter ces
problèmes cérébraux était significativement augmenté lors d’inflammation placentaire et
d’avantage encore lorsque cette inflammation touchait également le cordon et le fœtus.
De nombreuses publications confirment les effets neurotoxiques des endotoxines
bactériennes et des cytokines pro-inflammatoires sur le cerveau fœtal. La substance blanche
péri-ventriculaire et celle des régions subcorticales est particulièrement touchée.
L’inflammation induit une sensibilisation du cerveau à l’hypoxie. De plus, l’infection réduit la
régulation cardio-vasculaire, ce qui contribue significativement à la morbidité périnatale.
Ainsi l’injection intra-veineuse d’endotoxines à des brebis gestantes entraîne une diminution
transitoire de la circulation placentaire, ce qui contribue à provoquer une hypoxie chronique,
une hyper perfusion pulmonaire et une diminution de l’oxygénation cérébrale.
Aucune étude n’a, jusqu’à présent, démontré la relation entre l’importance de
l’infection vaginale et/ou cervicale pendant la gestation et la parturition prématurée, ni celle
de l’effet bénéfique et/ou protecteur d’un traitement pendant la gestation de ces infections
vaginales sur les naissances prématurées et leurs complications. L’identification des « juments
à risques », l’étude de leur flore bactérienne vaginale et la mise en place d’un traitement
adapté permettraient probablement de prévenir certaines naissances prématurées.
Les mécanismes physiopathologiques qui provoquent l’induction du travail et la
dilatation du col lors d’infections ascendantes ont été étudiés in vitro et in vivo. La présence
de bactéries induit la libération de cytokines pro-inflammatoires, telle l’interleukine-1 (Il-1) et
le facteur de nécrose tumorale (TNF) par les macrophages, l’amnios, l’endomètre et le
myomètre.
Il-1 et TNF-α, comme les endotoxines libérées par les bactéries à Gram négatif,
induisent une production élevée de prostaglandines et de corticostimuline (CRH) par les
cellules de l’endomètre, du trophoblaste et de l’amnios. Ces prostaglandines et l’endothéline
provoquent des contractions utérines. De plus, la production placentaire de prostaglandines est
stimulée par la corticostimuline (CRH). Par ailleurs, Il-1 et TNF-αinduisent la libération de
Il- 6 par les cellules de l’endomètre et les cellules trophoblastiques. Il-6 augmente la
production trophoblastique de prostaglandines et d’endothéline. Il-1 et TNF-α stimulent
également la production par les cellules trophoblastiques et cervicales de protéinases (MMP).
Ces protéinases induisent la déstructuration de la matrice extra cellulaire du myomètre et du
col, ce qui favorise la réponse inflammatoire. La texture des tissus utérins est réduite, le col
s’amollit et sous l’effet de l’augmentation de pression utérine, se dilate. Il-1 entraîne
également une libération de Il-8 par les cellules de l’endomètre, trophoblastiques et

cervicales. Ce qui provoque le recrutement de granulocytes qui libèrent une forte
concentration d’élastase. Cette élastase est également responsable de la déstructuration de la
matrice extra cellulaire du myomètre et du col. Cette pathogénie est confirmée par de
nombreuses études cliniques.(fig.1)
Fig.1 : Représentation schématique des mécanismes pathogéniques
induisant le travail et l’ouverture du col lors d’une infection ascendante du
tractus génital.
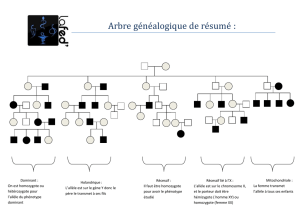
Depuis de nombreuses années la prédisposition génétique aux infections est discutée et
étudiée. Plusieurs enquêtes ont démontré la réalité de cette prédisposition. Ainsi dans une
étude danoise les enfants biologiques de parents morts avant l’âge de 50 ans d’une infection
ont près de 6 fois plus de « chance » de mourir d’infection que les autres. De même, des
mères nées avant terme ont un plus grand risque de mise bas prématurée. Un antécédent de
mise bas prématurée multiplie par trois le risque d’une autre naissance prématurée lorsque le
père est le même. Si le géniteur mâle est différent ce risque est réduit d’un tiers.
Ces observations ont conduit à rechercher des polymorphismes dans des gènes
candidats pouvant intervenir dans la pathogénie de la mise bas prématurée. Ont
particulièrement été étudiés les gènes régulant la réponse immunitaire maternelle durant la
gestation, ceux provoquant une réponse immunitaire inadéquate au stimulus infectieux.
Ainsi, la sécrétion de TNF-α par les monocytes montre une très grande variabilité
entre individus, variabilité probablement due au polymorphisme génétique. De fait, plusieurs
polymorphismes fonctionnels dans la région du promoteur de TNF-α ont été décrits. Un
polymorphisme spécifique dans la position –308 de la séquence nucléotidique (allèle TNF2)
est associé, dans l’espèce humaine, à une production accrue de TNF-α en réponse à une
stimulation.
Les individus porteurs de l’allèle TNF2 présentent des concentrations sériques en
TNF-α plus élevées que les autres, ils sont plus fréquemment atteints de septicémies et ont
une mortalité quatre fois plus élevée lors de celles-ci que les porteurs de l’allèle TNF1.

Un fœtus de génotype TNF2 aura un risque 3 fois plus élevé de naissance prématurée.
Et ce risque est augmenté par la présence d’une infection vaginale. Lors de ces naissances
prématurées la concentration amniotique en TNF-α est toujours plus élevée que lors de
naissance à terme. Cette association est indépendante du génotype maternel. Le risque de
naissance prématurée est plus important lorsque le génotype fœtal est homozygote TNF2
qu’hétérozygote pour cet allèle, il n’est cependant pas nul alors. C’est donc bien une
inflammation due à une réponse immunitaire inadéquate qui est responsable de l’induction
prématurée du travail.
Des résultats similaires sont observés avec d’autres cytokines pro-inflammatoires (Il-6,
Il-1β…). Dans ces études un accroissement significatif du risque de prématurité est observé
lors de polymorphisme induisant une réponse immunitaire exagérée. A l’inverse, un
polymorphisme conduisant à une réponse immunitaire réduite du fait d’une production
moindre de Il-6, est protectrice et est liée à un risque moindre de naissance prématurée.
(Fig.2)
Fig.2 : Morbidité périnatale et mortalité due à une réponse inflammatoire
inadéquate à une infection.
1
/
3
100%