Chapitre 5

Chapitre 5 - Amines
Solutionnaire des exercices
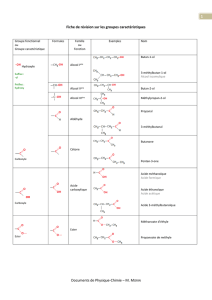
5.1 a) Alcool primaire d) Amine tertiaire
Amine primaire Dérivé halogéné secondaire
b) Amine secondaire e) Alcool tertiaire
Amine primaire
Dérivé halogéné secondaire
c) Amine secondaire f) Amine primaire
Dérivé halogéné primaire
5.2 a) N,2-diéthylbutan-1-amine
b) 6-chloro-3-éthyl-N,N-diméthylheptan-3-amine
c) cyclohexane-1,3-diamine
d) 3-méthoxyaniline ou m-méthoxyaniline
e) (3S,4S)-3-amino-7,7-diméthyloct-1-yn-4-ol
5.3 a) cyclobutylamine c) N-méthyl-N,N-dipropylamine
b) triéthylamine d) N-cyclopropyl-N,N-diméthylamine
NH2
CHON1
23
4
56
Chimie organique 2 - Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc. 1
5.4 a) d)
12345
NN
b) e)
OH
HN
123456
c)

5.5 L’absence de liaisons hydrogène intermoléculaires dans la triéthylamine ((CH3)3N),
contrairement à la situation prévalant dans la propylamine (CH3CH2CH2NH2), explique
en grande partie son point d’ébullition plus bas (3 C pour la triéthylamine et 49 C pour
la propylamine).
La géométrie plus « sphérique » des molécules de triéthylamine, comparativement à celle
plus « linéaire » de la propylamine, contribue également à diminuer la température
d’ébullition de celle-ci, puisque l’empilement plus difficile des molécules diminue les
forces de dispersion de London.
5.6 La formule C4H11N nous indique un degré d’insaturation de (((4 x 2) + 2) – (11-1)) / 2 =
0, ce qui signifie qu’il n’y a ni cycle, ni liaison .
Chaque composé suspect a des bandes C–H alcane (2965-2850) cm-1), ce qui ne donne
aucun indice sur la structure.
Toutefois, le composé A a une seule bande d’absorption dans la zone (3500-3300) cm-1, le
composé B en a deux, et le composé C aucune, ce qui nous indique que A est une amine
secondaire, B une amine primaire et C une amine tertiaire.
Voici les donc les structures possibles pour les composés A, B et C :
H
N
Chimie organique 2 - Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc. 2
NH2
NH2NH2
,,NH2,
, N
H
A : H
N
,
B :
N
C :

5.7 Toutes les amines représentées ont une même structure de base, dérivée de la pentana-1-
amine. La basicité dépendra donc uniquement de la nature des substituants présents
(électroattracteurs ou électrodonneurs) sur la chaîne latérale, de leur nombre et de leur
proximité de l’atome d’azote.
NH2
H3CCH3
NH2
NH2
I
NH2
Cl
NH2
Cl Cl
Ordre croissant
de basicité
NH2
5.8 a) A : B : NH4+Cl-
NH NH3+Br-
b) C : D :
NH3+Cl-
HN
c) E : F :
NH2
5.9 a) A : suivi de OH-, H2O, B :
chauffage
I
b) C :
Chimie organique 2 - Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc. 3

NO2
H2NBr
NH2
Chimie organique 2 - Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc. 4
O2NBr
5.10 A : B :
NH2
H2N
NH2
NH2
H2NCN
C : D :
NH2
N N
O
O
H
,
O
,CN
5.11 a) c)
O
O
N
HN
HH
b) d) On ne peut obtenir cette amine
,
par réduction d’une amide
ou d’un nitrile.
5.12
NH2
Br NH3(excès)
Br
NH2
O
H
O
1) phtalimidure
de potassium
2) OH-,H
2O
chauffage
LiAlH4(excès)
éther anhydre
suivi de
H3O+,H
2O
NH3
NaBH3CN, H2SO4
suivide
H3O+,H
2O

5.13 D’après ce que nous avons vu jusqu’à maintenant en chimie organique, le toluène est
neutre, alors que l’acide benzoïque est acide et la benzylamine, basique.
On devra donc dans un premier temps ajouter au mélange une phase aqueuse acide : celle-
ci transformera la benzylamine en son sel, qui sera dès lors plus soluble dans la phase
aqueuse que dans la phase organique. Une séparation des deux phases et une basification
de la phase aqueuse permettra de régénérer la benzylamine.
À la phase organique contenant maintenant le toluène et l’acide benzoïque, on refait le
même processus que précédemment, mais en utilisant cette fois-ci un milieu aqueux
basique, qui transformera l’acide benzoïque en son sel, plus soluble dans la phase aqueuse
que dans la phase organique. La séparation de la phase aqueuse de la phase organique et
son acidification permettront de régénérer l’acide benzoïque.
La phase organique ne contenant plus maintenant que le toluène, on a dès lors réussi à
isoler les trois substances dans trois récipients différents !
CH3COOH
CH2NH2
Phase organique
Agitation
Séparation
Mélange des phases
Chimie organique 2 - Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc. 5
CH3COOH CH2NH3+
Phase organique Phase aqueuse acide
Ajout d'une phase
aqueuse acide
CH2NH2
CH3COOH
Basification
Acidification
Agitation
Séparation
Mélange des phases
Ajout d'une phase
aqueuse basique
COO-
Phase organique Phase aqueuse basique
CH3
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%