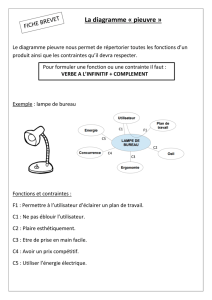
Semestre 2 – Chapitre 6 : Diagrammes potentiel-pH

Semestre 2 – Chapitre 6 : Diagrammes potentiel-pH
Nous avons étudié différents types de réactions chimiques impliquant des échanges de protons,
d'électrons, des équilibres de solubilités ou encore de complexation. Nous avons vu dans pour ces
différentes réactions que des diagrammes à une dimension permettaient de prévoir les réactions et les
domaines de stabilités des différentes espèces.
Certaines espèces chimiques sont engagés à la fois dans des couples acido-basiques et dans des couples
oxydant-réducteur, c'est pourquoi pour étudier ces systèmes chimiques il est nécessaire d'utiliser une
représentation à deux dimensions : il s'agit des diagrammes potentiel-pH (diagrammes E-pH), appelés
aussi diagrammes de Pourbaix.
I- Principe de construction des diagrammes E-pH :
1- Méthode :
Le diagramme E-pH d'un élément chimique est un graphique représentant la forme prédominante de cet
élément chimique en solution aqueuse, en fonction du potentiel (placé en ordonné) et du pH (placé en
abscisse). Il fait donc figurer des domaines d'existence ou de prédominance de ces espèces, séparés les
uns des autres par des frontières verticales, obliques ou horizontales.
1ère étape : Identifier les espèces mises en jeu, et déterminer le nombre d'oxydation de l'élément dans
chacune d'entre elles.
Remarques : Les espèces sont placés sur la diagramme par nombre d'oxydation croissante selon l'axe des
potentiels croissants ( « plus le n.o est élevé, plus l'espèce est en haut ») .
Deux espèces au même n.o seront séparés par des frontières verticales.
2ème étape : Identifier le type d'équilibre existant entre les différentes espèces :
Les équilibres de solubilité et acido-basiques feront apparaître des frontières verticales dans le
diagramme.
Les équilibres d'oxydo-réduction font apparaître des frontières horizontales ou obliques dont l'équation est
donnée par la loi de Nernst.
On peut à ce stade du raisonnement, tracer un diagramme de situation, qui est une ébauche du diagramme
potentiel-pH.
3ème étape : Choix des conventions frontières : Les conventions de tracés sont fixés par l'énoncé.
Lorsqu'on écrit la loi de Nernst ou lorsqu'on étudie les équilibres de solubilités, il convient de connaître
les concentrations de certaines espèces.
–La concentration de chaque espèce dissoute est prise égale à une valeur fixée ctra (énoncé).
–La pression partielle de chaque gaz est prise égale à Ptra (souvent 1bar)
–La frontière entre deux espèces en solution implique l'équirépartition de l'élément (égalité des
concentration à la frontière).
4ème étape : Examiner les équilibres un à un pour établir l'équation des différentes frontières.
Pour chaque couple oxydant-réducteur, on suffira la méthode suivante :
–annonce du couple oxydant/réducteur étudié
–écriture de la demi-équation d'oxydoréduction associée au couple
–écriture de l'équation de Nernst pour le couple étudié
–application des principales conventions fixant l’activité des différentes substances intervenant
dans l'équation de Nernst.
–Exprimer E en fonction du pH
1

2- Diagramme de l'eau :
Données : E°(H2O/H2 (g)) = 0,00V et E°(O2/H2O) = 1,23 V
Convention de tracé : PH2 = PO2 = 1bar.
→ Tracer le diagramme de l'eau à 298K en suivant la méthode précédente.
3- Diagramme du fer :
Considérons l'élément fer sous les formes suivantes :
Fe(s) , Fe2+, Fe3+ , Fe(OH)2 (s) et Fe(OH)3 (s)
Conventions de tracé : ctra = 10-2 mol/L
Données : E° (Fe3+/Fe2+) = 0,77V et E°(Fe2+/Fe) = -0,44V
pKs(Fe(OH)2) = 15,1 et pKs(Fe(OH)3) = 37,0
1- Déterminer les n.o du fer dans les différentes espèces chimiques. Anticiper les équilibres mis en jeu
entre les espèces. Anticiper qualitativement la place des différentes espèces sur le diagramme (on peut
tracer un diagramme de situation).
2- Frontières verticales : A partir de la condition de précipitation d'une espèce, déterminer pour quel pH
Fe2+ commence à précipiter sur forme Fe(OH)2 (s). Même question pour Fe(OH)3 (s).
3- Il y a 5 frontières de horizontales ou obliques. Déterminer l'équation de chaque frontière. On utilisera
le fait que le potentiel est continu à chaque frontière verticales pour déterminer les potentiels standards
qui ne sont pas données dans l'énoncé.) Tracer le diagramme.
a- Frontière Fe3+/Fe2+ (notée A)
b- Frontière Fe2+/Fe (s) (notée B)
c- Frontière Fe(OH)3 (s) /Fe2+ (notée C)
d- Frontière Fe(OH)3 (s) / Fe(OH)2(s) (notée D)
e- Frontière Fe(OH)2 (s)/Fe (s) (notée E)
II- Utilisation du diagramme pour prévoir une réaction ou la stabilité d'une espèce :
Un diagramme potentiel-pH est utilisé en superposition. Ceci signifie que deux diagrammes sont
superposés afin de permettre la lecture de réactions favorables.
Deux espèces Ox1 et Red2 engagés dans les couples oxydant/réducteur Ox1/Red1 et Ox2/Red2 réagissant
favorablement à l'occasion d'une réaction d'oxydoréduction dès que les domaines correspondant aux
espèces Ox1 et Red2 sont disjoint.
Application :
1- Rajouter les droites relativement au couple de l'eau sur le diagramme du Fer.
2- Quelles espèces du fer sont stables dans l'eau ?
3- Que se passe-t-il si l'on met du fer solide en contact d'eau en milieu basique ? Ecrire l'équation de
réaction.
4- Même question en milieu basique.
5- Que se passe-t-il si l'on place de l'hydroxyde de fer (II) dans l'air ambiant (humide)?
2

Remarque :
Les diagrammes potentiel-pH permettent d'étudier la thermodynamique des systèmes chimiques, ils disent
simplement si une réaction est possible ou non. Il est possible que pour des raisons cinétiques une réaction soit
bloquée. Pour étudier la cinétique des réactions d'oxydoréduction, il faut étudier les courbes intensité-potentiel …
au programme de deuxième année.
Un pas vers la deuxième année :
Les trois domaines du diagramme : sur un diagramme E-pH, on identifie trois domaines différents, dès lors qu'on
s'intéresse au phénomène de corrosion.
–domaine de la corrosion : c'est la région E-pH où le métal se trouve sous forme ionique. Il y a eu oxydation
du métal et donc corrosion pour donner une espèce soluble.
–domaine d'immunité : c'est le domaine de stabilité thermodynamique du métal. La corrosion étant
impossible thermodynamiquement ne peut donc pas se produire (la cinétique n'intervient pas dans ce cas).
–domaine de passivité : c'est le domaine où se trouvent les différentes phases condensées (en général des
oxydes et des hydroxydes) qui recouvrent le métal et le protègent d'une attaque ultérieure. Le métal a donc
été oxydé en surface, mais cette pellicule le protège d'une attaque en profondeur. On voit là tout l'intérêt
d'une couche protectrice très stable, compacte et fortement liée au métal.
→ Identifier ces domaines sur le diagramme E-pH du fer.
Exercices : (il n'y a pas de secret, pour acquérir la méthode, il faut s'entraîner!)
Exercice 1 : Diagramme potentiel-pH du zinc :
On donne le diagramme potentiel-pH du zinc, avec comme concentration de tracé ctra = 10-3 mol/L
1- Identifier les domaines de prédominance ou d'existence des espèces concernées : Zn(OH)2 , Zn(s) , Zn2+
et [Zn(OH)4]2-.
A partir du diagramme,
2- Déterminer le potentiel standard du couple Zn2+/Zn
3- Déterminer l'équation du segment (3)
4- Déterminer la valeur de Ks(Zn(OH)2).
3

Exercice 2 : Diagramme du cuivre :
On voudrait établir le diagramme simplifié de Pourbaix du cuivre à 298K. Pour cela on considère les espèces
suivantes : Cu(s), Cu+(aq), Cu2+(aq) Cu2O (s) et Cu(OH)2 (s) et on prend pour convention de tracé une concentration
arbitraire de 10-2 mol/L.
1- Déterminer le pH à partir duquel se forme Cu(OH)2 et Cu2O.
2- Dresser le diagramme de situation du cuivre.
3- Déterminer l'équation de la frontière 1 relative au couple Cu+/Cu.
4- Déterminer l'équation de la frontière 2 relative au couple Cu2+/Cu+.
5- Quelle incohérence apparaît alors sur le diagramme ? En déduire que l'espèce Cu+ est instable, déterminer la
nouvelle équation frontière pour le couple Cu2+/Cu (s).
Les frontières relatives aux autres couples du cuivre sont données : (vous pouvez le redémontrer si vous voulez
vous entraîner davantage.)
Frontière 4 : Cu2+ / Cu2O (s) : E4 = 0,10 + 0,06 pH
Frontière 5 : Cu2O (s) / Cu(s) : E5 = 0,46 – 0,06 pH
Frontière 6 : Cu(OH)2 (s) / Cu2O : E6 = 0,70 – 0,06 pH
6- Tracer le diagramme E-pH du cuivre et représenter le domaine de stabilité thermodynamique de l'eau.
7- Identifier les domaines de corrosion, de passivation et d'immunité du cuivre.
Données : E°(Cu+/Cu) = 0,52 V E°(Cu2+/Cu+)= 0,16 V
pKs1 (Cu2O) = 30 pour Cu2O (s) + H2O = 2 Cu+ + 2 HO- pKs2 (Cu(OH)2) = 20
Exercice 3 : Mélange d'acide chlorhydrique et d'eau de javel :
On dit souvent qu'il ne faut pas mélanger les
produits ménagers, c'est en particulier le cas de
l'eau de Javel avec tout produit à base d'acide.
Essayons de comprendre pourquoi. Le gaz
dichlore est un gaz toxique irritant, pouvant
entraîner des problèmes pulmonaires graves en
cas d'inhalation. Une solution aqueuse de
dichlore Cl2 (aq) peut libérer du dichlore Cl2 (g)
gazeux. L'eau de Javel est une solution aqueuse
comportant du chlorure de sodium (Na+ + Cl-)
et de l'hypochlorite de sodium (Na+ + ClO-) en
quantité équimolaire. Le diagramme potentiel-
pH simplifié de l'élément chlore est représenté
ce-dessous, pour les espèces chimiques HclO
(aq), ClO- (aq), Cl2 (aq) et Cl- (aq) et pour une
concentration de travail cT = 0,10 mol/L.
1- A l'aide du diagramme E-pH, retrouver la valeur du pKA du couple acido-basique HClO/ClO- et tracer
le diagramme de prédominance de ce couple. Quelle est l'espèce prédominante en milieu acide ?
2- Indiquer les espèces chimiques auxquelles correspondent les domaines notés A,B, C et D.
3- En utilisant le diagramme E-pH, prévoir l'évolution d'un mélange contenant les espèces A et C lors du
passage en milieu très acide (pH < 2,5)
4- En s'aidant des deux demi-équations électroniques relatives aux couples A/B et B/C, écrire l'équation
de la réaction entre les espèces A et C en milieu très acide.
5- Comment appelle-t-on la réaction mise en jeu entre les espèces A et C ? Calculer sa constante
d'équilibre à 298K.
6- Conclure quant à la consigne de sécurité figurant sur les flacons d'eau de Javel de ne pas mélanger un
acide avec de l'eau de Javel.
Données à 298 K : potentiels standard à pH = 0 :
E1° (HClO(aq)/Cl2(aq)) = 1,60V ; E2° (Cl2 (aq)/Cl-(aq)) = 1,39V
4

Semestre 2 – Chapitre 6 : Diagrammes potentiel-pH
Nous avons étudié différents types de réactions chimiques impliquant des échanges de protons,
d'électrons, des équilibres de solubilités ou encore de complexation. Nous avons vu dans pour ces
différentes réactions que des diagrammes à une dimension permettaient de prévoir les réactions et les
domaines de stabilités des différentes espèces.
Certaines espèces chimiques sont engagés à la fois dans des couples acido-basiques et dans des couples
oxydant-réducteur, c'est pourquoi pour étudier ces systèmes chimiques il est nécessaire d'utiliser une
représentation à deux dimensions : il s'agit des diagrammes potentiel-pH (diagrammes E-pH), appelés
aussi diagrammes de Pourbaix.
I- Principe de construction des diagrammes E-pH :
1- Méthode :
Le diagramme E-pH d'un élément chimique est un graphique représentant la forme prédominante de cet
élément chimique en solution aqueuse, en fonction du potentiel (placé en ordonné) et du pH (placé en
abscisse). Il fait donc figurer des domaines d'existence ou de prédominance de ces espèces, séparés les
uns des autres par des frontières verticales, obliques ou horizontales.
1ère étape : Identifier les espèces mises en jeu, et calculer le nombre d'oxydation de l'élément dans
chacune d'entre elles.
Remarques : Les espèces sont placés sur la diagramme par nombre d'oxydation croissante selon l'axe des
protentiels croissants ( « plus le n.o est élevé, plus l'espèce est en haut ») .
Deux espèces au même n.o seront séparés par des frontières verticales.
2ème étape : Identifier le type d'équilibre existant entre les différentes espèces :
Les équilibres de solubilité et acido-basiques feront apparaître des frontières verticales dans le
diagramme.
Les équilibres d'oxydo-réduction font apparaître des frontières horizontales ou obliques dont l'équation est
donnée par la loi de Nernst.
On peut à ce stade du raisonnement, tracer un diagramme de situation, qui est une ébauche du diagramme
potentiel-pH.
3ème étape : Choix des conventions frontières : Les conventions de tracés sont fixés par l'énoncé.
Lorsqu'on écrit la loi de Nernst ou lorsqu'on étudie les équilibres de solubilités, il convient de connaître
les concentrations de certaines espèces.
–La concentration de chaque espèce dissoute est prise égale à une valeur fixée ctra (énoncé).
–La pression partielle de chaque gaz est prise égale à Ptra (souvent 1bar)
–La frontière entre deux espèces en solution implique l'équirépartition de l'élément (égalité des
concentration à la frontière).
4ème étape : Examiner les équilibres un à un pour établir l'équation des différentes frontières.
Pour chaque couple oxydant-réducteur, on suffira la méthode suivante :
–annonce du couple oxydant/réducteur étudié
–écriture de la demi-équation d'oxydoréduction associée au couple
–écriture de l'équation de Nernst pour le couple étudié
–application des principales conventions fixant l’activité des différentes substances intervenant
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%