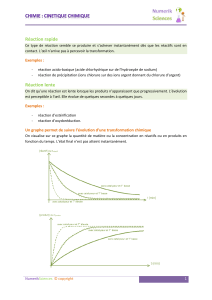
Chimie générale: La réaction chimique - Principes et applications
Telechargé par
mhamed.elaichaoui

Chimie générale
la réaction chimique
Lavoisier (1789):
« Lors d’une réaction chimique, la masse totale des réactifs
est égale à la masse totale des produits formés »
« Rien ne se perd, rien ne se crée, tout se transforme»

Réactifs / Produits
99
Réactifs / produits Une réaction chimique
n’est pas un mélange!!!
Réactifs: ce sont les composés qui sont présents avant la réaction chimique
(ici: Aet B)
Produits: ce sont les composés issus de la transformation des réactifs lors de la
réaction chimique (ici: C)
Coefficients stœchiométriques: ils correspondent au nombre de molécules de
réactifs transformés et de produits formés dans l’équation-bilan (ici: c)

Types de réaction
100
Réaction avec échange de particules (e-, H+)
Réaction d’oxydo-réduction
Réaction acide-base
Synthèse chimique
Substitution
Addition
Elimination
NB: il existe aussi les réactions de décomposition (cf H2O2) et de combustion

Equation-bilan
101
Nombre d’atomes A gauche (réactifs) A droite (produits)
Carbone
Oxygène
Hydrogène
Remplir le tableau suivant puis conclure…
Equilibrer une équation-bilan
Le nombre d’atomes engagés dans la réaction doit être égal de part
et d’autre de l’équation. Ainsi, les coefficients stœchiométriques
doivent parfois être ajustés pour décrire réellement la réaction
selon le principe de Lavoisier:

Equation-bilan
103
Comment équilibrer une équation de réaction
Méthodologie 1:
Ne pas changer les formules des espèces en jeu
On ajuste les coeff. stoechiométriques: on commence par tous
les éléments autres que Oxygène et Hydrogène jusqu'à ce que
l'équation soit équilibrée.
On termine si besoin par équilibrer en charge (cf. présence
d’ions)
NB: s’il apparait ne serait-ce qu’un coeff. stœchiométrique sous forme de
fraction, alors on multiplie l’ensemble de l’équation de manière à n’avoir que des
nombres entiers
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%