Compte rendu de TP : Titrage du vinaigre - Chimie Acide-Base
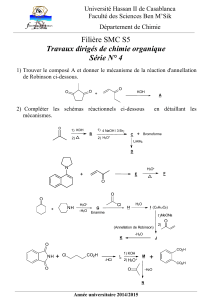
Telechargé par
Asma Idbraym

Compte rendu : Dosage d'un vinaigre
tp chimie
asma id braym et najia moussa ouhssain
1tsi3
La réaction est une réaction acide base
dont l’équation s’écrit : CH3COOH + OH–
H2O + CH3COO–
Avant de réaliser le dosage,
on a procédé à une dilution au
après tout l’expérience on obtient :
On a préparé 100 mL d’une solution (S) du vinaigre diluée 10 fois
On a ajouté progressivement la base par pas de 1 mL, mesurer après chaque ajout le pH de
la solution.
On a trouvé pH en fonction de Vb

D’après la méthode du tangentes on obtient ;
VbE = 18mL et pHE = 8.4
Et on à l’ équivalent La concentration CA de l’acide présent dans la solution diluée de vinaigre est
donnée par la relation suivante : ca*va=vb*ve
D’où ca=0.03 mol/l
Et on a d°=(n(ah))/ms=ca*m(ah)/peau=(0.03*60)/100=0.0018
Alors %=d°*100/c0=6%
Cette valeur est un peut proche de 8%
Interprétation théorique :
On a la réaction :
AH+HO-⇌ A-+ h2o
Déterminons sa constante d’équilibre K°
D’où le tableau d’avancement suivant :
Si v=0
k° ≪ 1 donc on peut supposer la réaction quasi-nulle et, donc, xf≪0.03 ce qui implique
que [Ah]≈0.03mol/l
Par ailleurs, comme nous dissolvons un acide dans l’eau, on peut supposer que le ph à
l’équilibre sera inférieur à 6 et donc que[h3o+] ≫ 10_6 et donc que [h3o+]=0.03mol/l .


1
/
4
100%