Hypocalcémie autosomique dominante: Rapport de cas pédiatrique
Telechargé par
fz.hinaje

1. Le récepteur sensible au calcium : physiologie et pathologie F. Faivre-Defrance, S. Marcelli-Tourvieille, M.-F. Odou, N. Porchet, J.-L. Wemeau, M.-C. Vantyghem Service d’Endocrinologie et Métabolisme,
Clinique Marc Linquette, avenue du professeur Laguesse, CHRU Lille, 59037 Lille Cedex. Laboratoire de biochimiebiologie moléculaire Pôle Biologie-Santé Eurasanté, CHRU Lille, 59037 Lille Cedex.
2. Pollak MR, Brown EM, Estep HL, McLaine PN, Kifor O, Park J, et al. Autosomal dominant hypocalcaemia caused by aCa(2+)- sensing receptor gene mutation. Nat Genet 1994; 8(3):303-7..
3. Hannan FM, Nesbit MA, Zhang C et al. Identification of 70 calcium-sensing receptor mutations in hyper- and hypocalcaemic patients: evidence for clustering of extracellular domain mutations at calcium-binding
sites. Human Molecular Genetics 2012;21:2768–78.
4. Pr Anne LIENHARDT-ROUSSIE/http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=FR&Expert=428#formulaire_reagir.php?lng=FR
5. Polycopié des enseignants en Endocrinologie, Diabète et Maladies métaboliques (3ème édition 2015) Item UE8-OT-265 Trouble ioniques Hypocalcemie
6. Chikatsu N, Watanabe S, Takeuchi Y, Muraosa Y, Sasaki S,Oka Y, Fukumoto S, Fujita T. A family of autosomal dominant hypocalcemia with an activating mutation of calcium-sensing receptor gene. Endocr J.
2003;50(1):91-6
7. Suzuki M, Aso T, Sato T, Michimata M, Kazama I, Saiki H, Hatano R, Ejima Y, Miyama N, Sato A, Matsubara M. A case of gainof- function mutation in calcium-sensing receptor: supplemental hydration is
required for renal protection. Clin Nephrol. 2005 Jun; 63(6):481-6.
Introduction :
Conclusion :
Le traitement de l’hypocalcémie autosomique dominante doit être considérée avec précaution et impose un suivi métabolique régulier.
Le pronostic reste variable et dépend de la sévérité de l’hypocalcémie et des conséquences éventuelles d’un traitement inapproprié.
HYPOCALCEMIE AUTOSOMIQUE DOMINANTE
FZ.Hinaje, FZ.Souilmi, M.Idrissi, M.HIDA
Service de Pédiatrie
CHU HASSAN II DE FES
L’hypocalcémie autosomique dominante est une maladie familiale rare caractérisée par une hypoparathyroïdie inappropriée associée à une hypocalcémie, une
hypomagnésémie et une hypercalciurie relative. Nous rapportons l'observation de L.K nourrisson de 6mois présentant des crises convulsives à répétition
hospitalisée au service de pédiatrie du CHU Hassan II de Fès.
Observation: Discussion:
Bibliographie :
L’hypocalcémie autosomique dominante (HAD) est une maladie
rare caractérisée par des taux bas de la parathormone (PTH)
inapproprié malgré une hypocalcémie et par une hypomagnésémie
et une hypercalciurie relative . Elle est liée à des mutations
activatrices du gène du récepteur sensible au calcium (CaSR)
capable d’inhiber la sécrétion de PTH et la réabsorption rénale du
calcium.
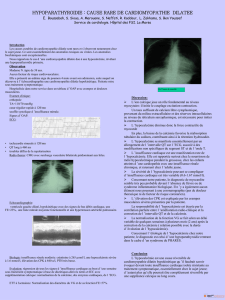
Le CaSR (calcium-sensing receptor:) est un membre de la famille
des récepteurs à 7 domaines transmembranaires couplés à la
protéine G (Figure1) [1], il est présent dans les cellules
parathyroïdiennes et au pôle basolatéral des cellules de la branche
ascendante large de l’anse de Henle dans le rein. Il permet de
moduler la production et la sécrétion de parathormone (PTH) et de
la calciurie en fonction de la calcémie [2,3]. Les mutations gain de
fonction CASR entraînent une augmentation de la sensibilité des
cellules parathyroïdiennes et rénales aux taux de calcium, faisant
apparaître l'hypocalcémie comme normale. Des mutations
activatrices de GNA1 (19p13.3) sont également décrites[4].
La présentation clinique est variable en fonction de la localisation
de la mutation, souvent l’hypocalcémie est asymptomatique et ne se
manifeste qu’à l’âge adulte. Mais parfois l’hypocalcémie dans sa
forme profonde peut se manifester àun âge précoce et être à
l’origine de tétanie et de convulsions comme était le cas chez notre
patiente. L’hypocalcémie chronique peut s’accompagner de la
cataracte sous-capsulaire (retrouvée chez notre patiente aussi) et
des calcifications des noyaux gris centraux, que l’on appelle le
syndrome de Fahr, responsable des signes extrapyramidaux et des
crises comitiales [5].
Le diagnostic d’HAD est suspecté sur une hypocalcémie avec
parfois notion d’hypocalcémie familiale (rapportée chez notre
patiente), le dosage de PTH se révèle inappropriée (basse ou
anormalement normale en regard de l’hypocalcémie).La calciurie
peut être normale dans les phases d’hypocalcémie profonde puis
elle s’élève après correction du taux de calcium (telle est le cas de
notre patiente) pouvant être à l’origine d’une maladie lithiasique
rénale et de néphrocalcinose, puis d’insuffisance rénale[6], surtout
chez les patients traités par calcium et vitamine D au long cours
sans surveillance de la calciurie. Parfois, une hypomagnésémie
modérée est associée.Le diagnostic est confirmé par le séquençage
du gène CASR puis du gène GNA1 si nécessaire (etude genetique).
Les traitements par calcium et vitamineD doivent être
administrés à dose raisonnable et sous surveillance stricte de la
calciurie et du volume de diurèse.L’association
d’hydrochlorothiazide et l’hydratation supplémentaires à ce
traitement permet une réduction nette de l’excrétion rénale du
calcium et de la concentration urinaire de calcium diminuant ainsi
le risque de cristallisation intra tubulaire des ions calcium et de
la formation de calculs rénaux[7]
FIGURE 2: Echographie renale
Nephrocalcinose bilaterale
FIGURE 3 TDM cérébrale
Agénésie partielle
du corps calleux
Nourrisson L.K âgée de 6mois, de sexe féminin, d’un couple
consanguin de premier degré
Ses antécédents personnels: un retard des acquisitions
psychomotrices avec un bon développement staturo-pondérale.
Ses antécédents familiaux: Deux de ses frères, une sœur et un
cousin paternel sont décédés à un âge précoce (à l’âge de 7mois,
4mois, 9mois et le cousin à l’âge d’un an) dans le même tableau
clinique.
Présente depuis l’âge de 1mois une dyspnée avec des crises
tonico-cloniques parfois hypertoniques d’où son hospitalisation
à à plusieurs reprises sans amélioration puis elle a été adressée
dans notre formation pour prise en charge.
L’examen clinique: Patiente hypotonique présentant des
crises convulsives tonico-cloniques généralisées à répétition, les
chiffres tensionnels étaient normaux. À l’examin abdominal:
pas d’hépato splénomégalie, à l’examin cardiovasculaire pas de
souffle ni de bruit surajoutés, à l’examin ophtalmologique: une
perte de poursuite oculaire était objectivée, le reste de l’examin
somatique était sans particularités.
Les examens complémentaires ont révélé les anomalies
suivantes :
-Bilan phospho-calcique: une hypocalcémie sévère:39mg (N:88-
108mg/l), une albuminémie normale: 40g/l, une
hypomagnésémie:13mg/l (N:19-25mg/l), une
hyperphosphorémie: 95mg/l (N:40-70mg/l), une hypovitaminose
D: 20,8 ng/ml (30-100 ng/ml), une Parathormone (PTH) : 0.
-Bilan urinaire: au départ une calciurie à1,4mg/kg/jr qui a
augmenté après normalisation des taux de calcium sous
traitement pour passer à8,4mg/kg/jr puis à18,8mg/kg/jr, une
magnésurie: 2,14mg/kg/jr, fonction rénale est normale
-ECG: allongement de l’espace QT en rapport avec son
hypocalcemie
-Échographie rénale:une néphrocalcinose bilatérale (Figure2).
-L’imagerie cérébrale a mis en évidence une agénésie partielle
du corps calleux, un élargissement des ventricules, un hygroma
fronto-temporal bilatéral et absence de calcifications des NGC
(Figure3).
Dans le cadre d’un dépistage familial: les parents ont
bénéficié d’un bilan biologique et radiologique revenant sans
anomalies en dehors d’une carence en vitamine D objectivé
chez la maman (à 4,5 ng/ml).
La patiente était mise sous fortes doses de calcium et du
magnésium (voie veineuse au départ puis par voie orale après
stabilisation), une suplémentation en vitamine D, elle a bénéficié
aussi d’une cure pour sa cataracte.
L’évolution était favorable sur le plan clinique (disparition
des crises) et biologique (normalisation du bilan biologique:
calcémie à 105mg/l , magnésémie à 20mg/l) avec élévation nette
de la calciurie 18,8 mg/kg/jr parallèlement à l’augmentation des
taux de calcémie d’où sa mise sous l’ hydrochlorothiazide.
FIGURE 1:Récepteur
sensible au calcium (CaSR)
1
/
1
100%