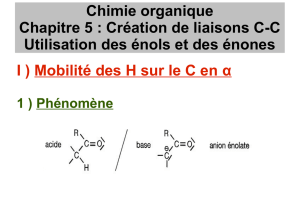
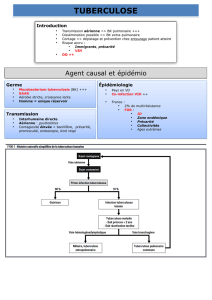
Objectifs
Mettre en évidence les zones de prédominance des formes acide et basique des indicateurs
colorés par une méthode spectrophotométrique.
Déterminer le pKAdu couple acide-base relatif au vert de bromocrésol.
Couleur et absorbance
Les indicateurs colorés sont des couples acide-base qui ont une
propriété visuelle intéressante : la forme acide notée InH n'a pas la
même teinte que la forme basique notée In-.
Dans le cas vert de bromocrésol (noté VBC), la forme acide est jaune
et la forme basique est bleue.
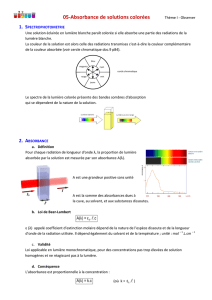
La courbe A = f (), obtenues à l’aide d’un spectrophotomètre, pour
une solution acide et pour une solution basique de VBC.
L'analyse des courbes
1. Déterminer les longueurs d'ondes
aet
bqui correspondent
respectivement au maximum d'absorbance de la forme acide InH
et de la forme basique In-.
2. Pourquoi peut-on dire que la forme acide est totalement
transparente si on éclaire la solution avec une lumière
monochromatique dont la longueur d'onde est
b?
3. En est-il de même avec la forme basique et la radiation
a?
L’absorbance et la concentration
1- On éclaire une solution contenant du VBC avec une lumière monochromatique de longueur d'onde
b. D'après la loi de Beer-Lambert, l'absorbance A de la solution est proportionnelle à la concentration
de la forme basique [In-] de cette solution (Voir TP cinetique) A = k . [ In-]relation (1)
La forme acide jaune, si elle est présente, absorbe-t-elle la lumière monochromatique de
longueur d'onde
b?
2- Soit C la concentration totale de l'indicateur coloré sous ses deux formes. On a la relation :
C = [ InH ] + [ In-]relation (2)
En milieu très basique, pH > 11, on peut considérer que seule existe la forme basique [ In-] et il est
possible de mesurer : Amax = k. C relation (3)
En utilisant les relations (1), (2) et (3), montrer que : [In-]
c=A
Amax
3- [ In-]
Cs'appelle la fraction centésimale molaire, c'est un nombre inférieur ou égal à 1 qu'il est
possible d'exprimer à l'aide d'un pourcentage.
Quelle relation très simple existe-t-il entre les fractions centésimales molaires de In-et de InH ?
Quelle est alors la fraction centésimale molaire de InH ?
Déduire la relation : [ In-]
[ InH ] =A
Amax- A
EXPERIENCE
On dispose de cinq solutions tampons notées S1à S5, dont les pH sont les suivants :
Solution S1S2S3S4S5
Définition
On appelle solution tampon, une solution dont
le pH reste constant après dilution ou après
un ajout modéré d’un acide ou d’une base
pH
cas du VBC 34567
INDICATEUR COLORE
TS

Dans cinq tubes à essais, introduire avec une pipette jaugée, 10 mL de chacune des cinq
solutions tampon.
Dans un sixième tube, introduire de la même façon, 10 mL d'une solution d'hydroxyde de
sodium de concentration 10-2 mol.L-1, dont le pH est voisin de 12.
Introduire dans chaque tube, 1 mL de VBC mesuré avec une pipette graduée .Bouche et agite
chaque tube par retournement.
Règler le spectrophotomètre sur
bet étalonner le zéro de l’absorbance avec une cuve remplie
d'eau distillée.
Les mesures
Mesurer l'absorbance A pour chaque solution en commençant par la solution d'hydroxyde de
sodium qui permet de connaître Amax = ………..
Complèter le tableau ci-dessous :
Valeur du pH
(indiquée sur le flacon) S1: S2: S3S4S5
Couleur
A
[ In-]/C
[ InH ]/C
R = [ In-]/[ InH ]
Log R
Exploitation
1. Tracer, dans un même repère, les courbes représentatives des fonctions : [ In-]/C = f (pH) et
[ InH ]/C = f (pH)
2. En utilisant la relation pH = pKA+ log ( [ In-]
[ InH ] ), montrer que le point d'intersection de ces deux
courbes permet de connaître le pKAdu couple acide-base de cet indicateur coloré.
3. Dans un autre repère, tracer la courbe pH = f(log [ In-]
[ InH ] ). Retrouver, sur ce graphique, la
valeur du pKa précédemment déterminée.
4. On estime que si l'une des formes colorées a une fraction centésimale molaire inférieure à
10%, elle ne peut pas être perçue visuellement dans le mélange.
Sur le graphe n°1, estimer les valeurs du pH qui correspondent à ces limites. Cet intervalle
s'appelle zone de virage. Pourquoi le pKAest- il obligatoirement dans cette zone de virage ?
Conclusion:
Sur un axe horizontal gradué en unités de pH, représenter les trois zones suivantes (zone de
prédominance de la teinte acide, zone de virage, zone de prédominance de la teinte basique) et
indique les couleurs correspondantes dans la bande inférieure :
Cas du VBC
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13
Couleurs
Les indicateurs colorés, tout comme les autres couples acide-base, sont caractérisés par leur
quotient de réaction à l'équilibre, Qr(eq), encore appelé constante d'acidité KA. A une température
donnée cette constante ne dépend que de la nature du couple acide-base qui constitue l'indicateur
coloré.
1
/
2
100%