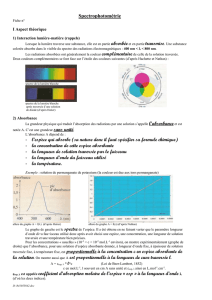
SUIVI TEMPOREL D`UNE REACTION CHIMIQUE

SUIVI TEMPOREL D’UNE REACTION CHIMIQUE
PAR SPECTROPHOTOMETRIE
Principe : On peut déterminer la concentration de diiode dans une solution par la mesure de
l’absorbance de celle-ci. Ceci va nous permettre de suivre dans le temps l’évolution d’une
transformation chimique dans laquelle le diiode intervient.
I) Manipulation :
Réglages de l’interface :
Connecter la sortie absorbance du spectrophotomètre à la voie A de l’interface.
Paramétrer celle-ci en absorbance A sans étalonnage.
Régler l’acquisition sur 32 points en balayage temporel pendant 30 min.
Réglage du spectrophotomètre :
Remplir une cuve avec la solution d’iodure de potassium, la placer dans le
spectrophotomètre.
Sélectionner la longueur d’onde λ=585 nm et régler le zéro d’absorbance.
Réalisation de l’expérience :
Dans un bécher, prélever 10,0 ml d’une solution d’iodure de potassium à 1,0 mol.L-1.
Dans un autre, prélever 10,0 ml d’une solution de peroxodisulfate d’ammonium à 0,1 mol.L-1.
Mélanger le contenu des deux béchers en déclanchant l’acquisition.
En moins d’une minute, homogénéiser et remplir une cuve avec le mélange.
L’introduire dans le spectrophotomètre à la place de la cuve précédente.
A la fin de la saisie, sauver les mesures dans Regressi.
II) Traitement des mesures:
Calculs préparatoires :
Ecrire l’équation de la réaction réalisée.
Dresser un tableau d’avancement de celle-ci.
Appliquer la loi de Beer-Lambert à l’espèce absorbante, l’exprimer en fonction de
l’avancement x.
Déduire l’expression de l’avancement x en fonction de l’absorbance A(t) et de sa valeur
maximale Amax.
Dans Regressi :
Dans le tableau, relever la valeur Amax.
Saisir les expressions de l’avancement x et des quantités de matière de chaque espèce.
Tracer le graphe x(t) et modéliser sa tangente à l’origine et son asymptote.
Déterminer le temps de demi-réaction.
Calculer la vitesse de réaction et tracer son graphe temporel. Conclure sur son évolution.
Tracer sur un même graphe l’évolution temporelle des quantités de matières des diverses
espèces en choisissant des axes appropriés.
III) Influence des facteurs cinétiques :
Recommencer l’expérience en faisant varier un facteur : température des solutions ou
concentration de la solution d’iodure de potassium.
Superposer les graphes x(t) des diverses pages obtenues afin de conclure sur l’influence de ces
facteurs.
1
/
1
100%