Pneumatose Kystique Intestinale : Causes, Diagnostic, Traitement
Telechargé par
patxi

9-061-A-30
Pneumatose
kystique
intestinale
M.-A.
Bigard, C.
Laclotte-Duhoux
Affection
rare
caractérisée
par
la
présence
de
kystes
gazeux
dans
la
paroi
intestinale,
la
pneumatose
kystique
intestinale
peut
atteindre
l’ensemble
du
tube
digestif,
avec
une
prédilection
pour
l’intestin
grêle
et
le
côlon.
Cette
pathologie
est
plus
fréquente
chez
l’homme
et
après
l’âge
de
50
ans.
La
pneumatose
kystique
intestinale
peut
être
idiopathique
ou
le
plus
souvent
secondaire
à
diverses
maladies.
Les
formes
primitives
touchent
préférentiellement
le
côlon
gauche
avec
des
kystes
gazeux
essentiellement
sous-
muqueux,
alors
que
les
pneumatoses
kystiques
intestinales
secondaires
atteignent
plutôt
l’intestin
grêle
avec
des
kystes
gazeux
surtout
sous-séreux.
L’origine
de
cette
pathologie
est
multifactorielle,
mais
la
cause
principale
n’est
pas
définitivement
prouvée.
La
longue
liste
des
associations
pathologiques
a
conduit
à
l’élaboration
de
diverses
théories
étiopathogéniques
qui
ne
sont
pas
antinomiques
puisque
certains
mécanismes
peuvent
être
associés.
Le
plus
souvent
asymptomatique
et
donc
de
découverte
fortuite,
la
pneumatose
kystique
intestinale
peut
être
aussi
révélée
par
des
émissions
glairosanglantes,
des
douleurs
abdominales,
de
la
diarrhée.
Les
examens
endoscopiques
et
radiologiques
font
aisément
le
diagnostic
et
évitent
des
laparotomies
inutiles
en
cas
de
pneumopéritoine
bénin.
La
physiopathologie
de
l’affection
reste
mal
connue.
Le
traitement
varie
selon
l’étiologie.
Pour
les
formes
primaires,
une
antibiothérapie
permettant
de
diminuer
la
flore
colique
productrice
d’hydrogène
est
indiquée
en
première
intention.
En
cas
d’échec,
une
oxygénothérapie
au
masque
ou
hyperbare,
qui
va
favoriser
le
remplacement
de
l’hydrogène
par
de
l’oxygène,
doit
être
tentée.
Pour
les
formes
secondaires,
le
traitement
est
celui
de
l’affection
causale.
Dans
la
plupart
des
cas,
la
pneumatose
kystique
intestinale
est
asymptomatique
et
aucun
traitement
n’est
nécessaire.
La
chirurgie,
quant
à
elle,
doit
rester
réservée
aux
formes
particulièrement
graves
et
compliquées.
©
2017
Elsevier
Masson
SAS.
Tous
droits
réservés.
Mots-clés
:
Pneumatose
kystique
intestinale
;
Kystes
gazeux
;
Germes
anaérobies
;
Pneumopéritoine
Plan
■Introduction
1
■Généralités
1
Anatomopathologie
2
Épidémiologie
2
■Étiopathogénie
2
Associations
pathologiques
2
Hypothèses
physiopathologiques
4
■Diagnostic
4
Circonstances
cliniques
4
Examens
paracliniques
4
■Traitement
6
Médical
6
Chirurgie
7
■Conclusion
7
Introduction
La
pneumatose
kystique
intestinale
est
une
affection
rare
et
curieuse,
définie
par
la
présence
de
kystes
gazeux
dans
la
paroi
digestive,
d’évolution
habituellement
bénigne.
Sa
connaissance
est
nécessaire
afin
d’éviter
une
inflation
d’explorations
et
de
mesures
thérapeutiques
sans
bénéfice
pour
le
patient.
Généralités
Le
terme
de
pneumatose
kystique
intestinale
est
apparu
en
1825
chez
le
porc
et
en
1730
chez
un
cadavre
humain.
Depuis
lors,
plusieurs
publications
ont
apporté
d’importantes
informations
épidémiologiques [1,
2].
Les
tentatives
de
délimitation
nosologique
se
heurtent
à
d’importants
problèmes
de
nomenclature.
Ainsi,
c’est
la
traduc-
tion
littérale
pneumatosis
cystoides
intestinalis
que
l’on
retrouve
dans
l’Index
medicus.
Cependant,
de
nombreux
termes
semblent
être
utilisés
indifféremment
ou
peu
différemment
par
les
auteurs
anglo-saxons
:
intestinal
emphysema,
pneumatosis
intestinalis,
pneu-
matosis
coli,
bullous
emphysema,
gas
cysts
of
the
intestine,
intramural
intestinal
gas [3].
Knechtle
sépare
la
pneumatose
kystique
intes-
tinale,
affection
primitive,
de
toutes
les
maladies
secondaires
comportant
la
présence
de
gaz
intrapariétal [4].
De
nombreuses
publications
mêlent
les
descriptions
d’affections
dont
les
physio-
pathologies
et
les
pronostics
sont
parfois
radicalement
différents.
Pour
les
auteurs
franc¸ais,
la
pneumatose
kystique
intestinale
est
une
entité
pathologique
caractérisée
par
la
présence
de
kystes
EMC
-
Gastro-entérologie 1
Volume
14
>
n◦1
>
janvier
2019
http://dx.doi.org/10.1016/S1155-1968(17)77963-1
© 2019 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 15/06/2019 par UNIVERSITE VICTOR SEGALEN BORDEAUX (14200). Il est interdit et illégal de diffuser ce document.

9-061-A-30 Pneumatose
kystique
intestinale
Figure
1.
Kystes
sous-séreux
aspect
opératoire.
Figure
2.
Kystes
sous-muqueux
pièce
opératoire.
gazeux
dans
la
paroi
du
tube
digestif.
Un
élément
important
de
définition
est
son
évolution
très
généralement
bénigne.
Elle
est
classiquement
secondaire
à
une
grande
variété
d’affections
diges-
tives
ou
extradigestives,
mais
en
pratique
souvent
idiopathique.
Cette
affection
bénigne
est
à
distinguer
de
la
pneumatose
dif-
fuse
ou
emphysème
intestinal,
toujours
secondaire,
où
le
gaz
est
produit
par
la
nécrose
pariétale
ou
l’invasion
bactérienne,
comme
dans
l’entérocolite
nécrosante,
l’ischémie
intestinale,
les
formes
graves
de
colite
pseudomembraneuse
ou
de
colite
cryp-
togénétique,
et
dont
l’évolution
est
fulminante.
En
pratique,
le
gastroentérologue
est
amené
à
rencontrer
essentiellement
la
pneu-
matose
kystique
colique
avec
des
kystes
sous-séreux
découverts
le
plus
souvent
de
fac¸on
fortuite,
le
principal
problème
étant
d’éviter
la
confusion
avec
des
polypes
adénomateux
ou
un
lymphome.
Anatomopathologie
Dans
les
pneumatoses
de
l’intestin
grêle
(40
%),
les
kystes
sont
le
plus
souvent
sous-séreux,
sur
le
bord
mésentérique [5],
ce
qui
explique
qu’ils
sont
visibles
par
le
chirurgien
au
cours
d’une
laparotomie
et
qu’ils
peuvent
être
responsables
d’un
rétropneu-
mopéritoine
(Fig.
1).
Dans
les
atteintes
coliques
(35
%),
les
kystes
sont
préférentiellement
situés
dans
la
sous-muqueuse
(Fig.
2)
et
exceptionnellement
dans
la
musculeuse [6–8].
L’atteinte
simultanée
du
côlon
et
du
grêle
est
retrouvée
dans
20
%
des
cas [6,
9].
La
localisation
de
la
pneumatose
kystique
intestinale
peut
être
œsophagienne,
intestinale,
colique
ou
rectale [6,
7,
10–12].
Au
niveau
colique,
le
sigmoïde
est
concerné
dans
70
%
des
cas,
suivi
du
côlon
descendant
dans
40
%
des
cas
et
des
autres
segments
dans
15
%
à
25
%
des
cas,
dont
10
%
pour
le
cæcum.
La
pneumatose
peut
aussi
toucher
d’autres
organes
intra-abdominaux
tels
que
le
mésentère,
le
péritoine,
le
grand
épiploon,
la
vessie,
le
canal
inguinal
et
le
vagin.
Figure
3.
Aspect
anatomopathologique.
La
taille
des
kystes
varie
de
quelques
millimètres
à
quelques
cen-
timètres,
allant
jusqu’à
30
cm [12].
Histologiquement,
les
kystes
ont
une
paroi
fine
qui
ne
communique
pas
avec
la
lumière
du
tube
digestif
(Fig.
3).
Leur
contenu
gazeux
est
très
riche
en
hydrogène
et
en
azote [13] avec
une
petite
quantité
d’oxygène
et
de
gaz
carbonique
;
le
méthane
n’y
est
présent
qu’en
quan-
tité
négligeable [14–16].
Les
kystes
sont
délimités
par
une
fine
membrane
qui
contient
des
histiocytes
aplatis
dans
les
formes
jeunes
et
quelques
cellules
géantes
dans
les
formes
vieillies [17]
(Fig.
1).
Dans
certains
cas,
la
muqueuse
adjacente
est
le
siège
d’une
réaction
inflammatoire
modérée
avec
des
leucocytes
et
des
macrophages.
On
ne
met
en
évidence
aucune
structure
évocatrice
de
vaisseau
lymphatique.
La
présence
de
quelques
cellules
de
type
méso-
thélial
en
immunohistochimie
a
été
rapportée
dans
les
kystes
sous-séreux [18].
Épidémiologie
La
pneumatose
kystique
est
peu
fréquente,
mais
sa
fréquence
est
probablement
sous-estimée.
Sur
une
série
autopsique
de
6553
sujets,
deux
cas
seulement
étaient
recensés,
soit
une
préva-
lence
de
30/100
000 [19].
Les
publications
récentes
ne
font
souvent
état
que
de
quelques
cas
et
rapportent
essentiellement
des
asso-
ciations
à
des
états
pathologiques
variés.
La
pneumatose
touche
de
préférence
les
hommes
(sex-ratio
:
3,5/1)
après
50
ans [20,
21],
bien
que
certaines
séries
aient
retrouvé
plutôt
une
prédominance
féminine [13].
Une
revue
récente
de
la
littérature
centrée
sur
la
pneumatose
kystique
chez
l’adulte
a
retrouvé
52
cas
publiés
de
2010
à
2014,
avec
un
âge
moyen
de
60
ans
et
52
%
de
femmes.
Le
diagnostic
était
fait
par
tomodensitométrie
dans
94
%
des
cas,
et
69
%
des
patients
guérissaient [22].
Étiopathogénie
Associations
pathologiques
La
pneumatose
kystique
intestinale
est
primitive
dans
15
%
des
cas
et
siège
sur
le
côlon
gauche
;
elle
est
secondaire
dans
85
%
des
cas
et
atteint
plus
volontiers
le
côlon
droit
et
l’intestin
grêle.
De
nombreuses
associations
pathologiques
ont
été
décrites
avec
la
pneumatose
kystique
intestinale,
de
la
plus
bénigne
à
la
plus
grave [23].
Ainsi,
devant
une
pneumatose
intestinale
décou-
verte
à
l’occasion
d’un
examen
tomodensitométrique
(TDM)
de
l’abdomen,
il
est
nécessaire
de
réaliser
aussi
une
évaluation
clinicobiologique
du
patient
;
ceci
permet
de
différencier
la
pneu-
matose
chronique
«
maladie
»
de
la
pneumatose
intestinale
«
symptôme
»
au
cours
d’une
atteinte
aiguë,
souvent
ischémique,
dont
le
pronostic
et
la
prise
en
charge
sont
très
différents.
2EMC
-
Gastro-entérologie
© 2019 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 15/06/2019 par UNIVERSITE VICTOR SEGALEN BORDEAUX (14200). Il est interdit et illégal de diffuser ce document.

Pneumatose
kystique
intestinale 9-061-A-30
Tableau
1.
Affections
associées
à
la
pneumatose
kystique
intestinale.
Affections
digestives
Sténose
œsophagienne
Ulcère
gastroduodénal,
sténose
pylorique,
cancer
gastrique
Diverticulose
jéjunale
Entérocolite
nécrosante
Maladies
inflammatoires
cryptogénétiques
de
l’intestin
Pseudo-obstruction
intestinale
chronique,
iléus
intestinal
(quadriplégie)
Anastomoses
intestinales,
court-circuit
jéjuno-iléal
(pour
obésité),
grêle
court
Occlusion
intestinale,
volvulus,
strangulation
Diverticulite
colique,
abcès
péricolique,
appendicite
Dolichocôlon
Maladie
de
Hirschsprung,
mégacôlon
idiopathique,
fécalome,
périnée
descendant
Tuberculose
intestinale,
mégacôlon
toxique,
colite
pseudomembraneuse,
sprue
réfractaire
Maladie
cœliaque
Cancer
du
côlon,
métastase
du
mésentère,
cholangiocarcinome
Traumatisme
abdominal
Lithiase
biliaire
Hépatopathies
Bronchopneumopathie
chronique
obstructive
et
cardiopathie
Mucoviscidose
Asthme
Sarcoïdose
Transplantation
d’organes
Moelle
osseuse,
rein,
foie,
cœur,
poumon
Médicaments
Corticothérapie
Anti-inflammatoires
non
stéroïdiens
Chimiothérapies
:
méthotrexate,
daunorubicine,
cytosine-arabinoside,
5-fluorouracile,
cyclophosphamide,
mercaptopurine
Ciclosporine
Lactulose,
sorbitol,
inhibiteurs
de
l’␣-glucosidase,
monoxyde
d’azote,
practolol
Maladies
de
système
Polyartérite
noueuse
Sclérodermie
Dermatomyosite
Lupus
érythémateux
disséminé
Connectivites
mixtes
Syndrome
néphrotique
Infections
Clostridium
perfringens
Cytomégalovirus,
sida
Cryptosporidiose,
Mycobacterium
avium
Autres
:
Candida
albicans,
staphylocoques
à
coagulase
négative,
Lactobacillus,
Klebsiella,
virus
varicelle-zona,
rotavirus
Gestes
invasifs
Endoscopie
Clip
mitral
par
voie
percutanée
Cathéters
jéjunaux
Toxiques Trichloroéthylène
Sida
:
syndrome
de
l’immunodéficience
acquise.
On
note
une
évolution
au
cours
du
temps
des
différentes
étio-
logies
;
celles-ci
étaient
autrefois
surtout
digestives
(ulcères),
alors
qu’actuellement
la
chimiothérapie
et
l’immunosuppression
sont
les
causes
le
plus
fréquemment
retrouvées.
Le
Tableau
1
énumère
les
causes
les
plus
fréquemment
associées
à
une
pneumatose
digestive.
Dans
la
majorité
des
cas,
la
résolution
spontanée
est
la
règle.
Affections
digestives
La
sténose
pylorique
serait
responsable
d’un
tiers
des
cas
de
toutes
les
pneumatoses
kystiques
intestinales
et
de
50
%
à
58
%
des
formes
du
grêle [16],
le
côlon
serait
peu
atteint
et
un
pneumopéri-
toine
asymptomatique
serait
assez
fréquent.
La
maladie
cœliaque,
la
pseudo-obstruction
chronique
sont
des
causes
bien
connues
de
pneumatose
digestive
bénigne [24–27].
L’association
de
ces
affections
digestives
avec
la
pneumatose
kystique
intestinale
repose
sur
la
théorie
mécanique
décrite
plus
loin,
qui
suggère
la
pénétration
d’air
à
travers
la
muqueuse
digestive
par
traumatisme
de
celle-ci
et/ou
par
augmentation
de
la
pression
endoluminale.
Le
rôle
de
la
rupture
de
la
barrière
muqueuse
est
évoqué
par
l’association
de
la
pneumatose
kystique
intestinale
avec
l’ulcère,
la
maladie
de
Crohn [27] et
les
lésions
traumatiques
chirurgicales
et
endoscopiques [28].
L’association
pneumatose
kystique
intestinale
et
cancer
est
rare-
ment
rapportée [29,
30].
Affections
pulmonaires
Les
causes
pulmonaires
de
pneumatose
digestive
sont
congé-
nitales,
comme
la
mucoviscidose,
ou
acquises,
comme
l’asthme,
la
sarcoïdose
ou
la
bronchopneumopathie
chronique
obstruc-
tive [31–33].
Leur
association
à
la
pneumatose
kystique
intestinale
repose
sur
la
théorie
pulmonaire.
Dans
le
cas
de
la
mucoviscidose,
la
pneumatose
kystique
intestinale
est
presque
toujours
associée
à
un
pneumothorax,
un
pneumomédiastin
ou
un
emphysème
pulmonaire,
qui
ne
sont
présents
que
dans
deux
cas
sur
trois
en
l’absence
de
pneumatose
kystique
intestinale
;
ces
constatations
sont
probablement
liées
au
caractère
évolué
de
la
maladie.
Transplantation
d’organes
et
immunosuppression
Dans
un
contexte
de
transplantation
d’organes,
la
pneumatose
digestive
est
le
plus
souvent
bénigne,
mais
elle
peut
également
être
grave,
en
particulier
après
transplantation
de
moelle [34,
35].
Une
pneumatose
pariétale
peut
traduire
une
réaction
sévère
du
greffon
contre
l’hôte [36].
Après
transplantation
pulmonaire,
la
pneumatose
digestive
peut
être
secondaire
aux
traitements
immunosuppresseurs
mais
aussi
à
une
infection
opportuniste
par
le
cytomégalovirus [37,
38].
Des
cas
de
pneumatose
colique
après
transplantation
rénale,
car-
diaque
et
hépatique
ont
également
été
rapportés [39,
40].
Dans
les
greffes
de
rein,
elle
est
constatée
10
à
25
jours
après
la
transplan-
tation.
Elle
est
alors
due
à
la
prise
au
long
cours
de
corticoïdes
qui
EMC
-
Gastro-entérologie 3
© 2019 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 15/06/2019 par UNIVERSITE VICTOR SEGALEN BORDEAUX (14200). Il est interdit et illégal de diffuser ce document.

9-061-A-30 Pneumatose
kystique
intestinale
entraînent
une
altération
de
la
muqueuse
et
de
la
sous-muqueuse
digestive,
surtout
lorsque
ceux-ci
sont
associés
à
la
ciclosporine
à
forte
dose.
La
pneumatose
kystique
intestinale
peut
aussi
être
secondaire
à
des
traitements
de
chimiothérapie,
notamment
après
utilisation
d’inhibiteurs
de
la
tyrosine
kinase [41–43].
Maladies
de
système
La
pneumatose
kystique
intestinale
peut
se
rencontrer
dans
des
formes
très
évoluées
de
sclérodermie [24,
44,
45].
Elle
atteindrait
exclusivement
le
grêle.
Des
cas
de
pneumatose
kystique
intestinale
associée
à
une
dermatomyosite
ou
à
un
lupus
érythémateux
dissé-
miné
ont
été
décrits
chez
l’enfant
et
chez
l’adulte,
et
comportaient
toujours
une
vascularite
intestinale [46–51].
Infections
La
survenue
d’une
pneumatose
pariétale
au
cours
du
syn-
drome
de
l’immunodéficience
acquise
(sida)
a
été
rapportée,
secondaire
à
des
atteintes
infectieuses
variées
telles
que
cryptospo-
ridiose,
cytomégalovirose,
mycobactériose
(Mycobacterium
avium
intracellulaire) [52–55].
Elle
est
majoritairement
cæcale
mais
peut
également
s’étendre
au
côlon
droit.
Dans
certains
cas,
il
est
pos-
sible
d’observer
une
pneumatose
digestive
traduisant
une
nécrose
ischémique.
Dans
ce
contexte,
la
diarrhée
infectieuse
serait
non
seulement
à
l’origine
de
lésions
de
la
muqueuse
colique,
mais
produirait
aussi
une
hyperpression
intraluminale.
Causes
iatrogènes
L’exposition
prolongée
au
trichloréthylène
favorise
la
surve-
nue
de
pneumatose
kystique
intestinale,
d’après
des
observations
japonaises,
essentiellement
au
niveau
du
côlon
gauche [56–59].
Ce
solvant
organique
aurait
un
effet
potentiellement
anesthésique
sur
le
système
nerveux
autonome,
entraînant
des
perturba-
tions
du
péristaltisme
intestinal
participant
au
développement
de
l’emphysème.
Le
trichloréthylène
ou
ses
métabolites
(trichlo-
roéthanol
et
acide
trichloracétique)
pourraient
également
agir
sur
la
flore
bactérienne
intestinale
et
favoriser
la
prolifération
de
bactéries
produisant
des
gaz
contenus
dans
les
kystes.
Il
serait
éga-
lement
un
puissant
inhibiteur
de
la
consommation
d’hydrogène
par
les
bactéries
coliques.
Des
cas
de
pneumatose
kystique
intestinale
ont
été
décrits
après
introduction
d’inhibiteurs
de
l’␣-glucosidase,
régressive
à
l’arrêt
du
traitement [60–62].
L’inhibition
de
l’␣-glucosidase
ralentit
la
digestion
des
glucides
et
diminue
leur
absorption,
aboutissant
à
une
baisse
des
glycémies
postprandiales.
La
fer-
mentation
bactérienne
des
hydrates
de
carbone
non
absorbés
produit
de
l’hydrogène,
du
dioxyde
d’oxygène
et
du
méthane.
Cette
augmentation
de
volume
gazeux
entraîne
une
hyperpres-
sion
intraluminale
à
l’origine
de
la
pneumatose.
Les
mêmes
observations
ont
été
faites
pour
la
prise
au
long
cours
de
sorbi-
tol
ou
de
lactose [63].
Noter
un
cas
de
pneumatosis
intestinalis
après
pose
d’une
valve
mitrale
par
voie
percutanée [64].
Hypothèses
physiopathologiques
Il
est
clairement
établi
que
l’origine
de
la
pneumatose
diges-
tive
est
multifactorielle,
mais
la
cause
principale
n’est
pas
définitivement
prouvée.
Trois
théories
principales
ont
été
propo-
sées [7,
22,
65–67].
Une
première
théorie,
dite
«
mécanique
»,
émet
l’hypothèse
que
le
gaz
réalise
une
dissection
sous-muqueuse
à
partir
de
la
lumière
digestive
en
raison
d’une
hyperpression
intraluminale
locale
secondaire
à
une
obstruction
digestive.
Cette
théorie
se
fonde
sur
des
observations
de
pneumatose
après
endoscopie
diges-
tive
ou
au
cours
de
maladie
modifiant
la
motilité
intestinale
comme
la
pseudo-obstruction
chronique.
Les
traitements
immu-
nosuppresseurs
et
corticoïdes
pourraient
entraîner
une
déplétion
lymphocytaire
au
niveau
des
plaques
de
Peyer
et
ainsi
favoriser
la
diffusion
des
gaz
par
les
defects
muqueux.
Une
deuxième
théorie,
dite
«
pulmonaire
»
et
proche
de
la
pre-
mière,
émet
l’hypothèse
que
l’hyperpression
thoracique
présente
chez
les
sujets
atteints
de
bronchopneumopathie
chronique
obs-
tructive
ou
d’asthme
serait
responsable
d’une
diffusion
de
gaz
vers
les
séreuses
digestives
en
suivant
un
trajet
périvasculaire
ou
péri-
lymphatique
par
un
relais
médiastinal.
Cependant,
cette
théorie
ne
permet
pas
d’expliquer
la
prédominance
colique
gauche
des
kystes,
ni
leur
richesse
en
hydrogène,
bien
supérieure
à
celle
de
l’air
alvéolaire
(traces).
Une
troisième
théorie,
bactérienne,
suggère
qu’une
pullulation
de
germes
anaérobies
est
à
l’origine
de
la
formation
de
gaz
qui
pénètrent
dans
la
paroi
digestive
par
des
plaies
muqueuses
ou
en
raison
d’une
hyperperméabilité
muqueuse.
Cette
théorie
se
fonde
sur
l’analyse
des
bulles
gazeuses
de
pneumatose
dont
la
teneur
élevée
en
hydrogène
et
en
azote,
résultant
tous
deux
de
la
fermentation
bactérienne,
suggère
une
pullulation
microbienne
anaérobie.
La
troisième
théorie
est
la
plus
communément
admise,
d’autant
plus
que
la
teneur
en
hydrogène
mesurée
lors
d’un
test
respi-
ratoire
chez
des
patients
ayant
une
pneumatose
digestive
est
significativement
plus
élevée
que
la
normale [14,
15,
68],
ce
qui
tra-
duit
une
augmentation
de
l’activité
anaérobie
par
insuffisance
de
la
flore
bactérienne
transformant
l’hydrogène
en
méthane
(Methanobrevibacter
smithii).
De
plus,
l’injection
expérimentale
de
germes
anaérobies
dans
la
sous-muqueuse
d’un
animal
est
responsable
d’une
pneumatose
digestive [67].
Enfin,
plusieurs
publications
rapportent
la
disparition
de
pneumatoses
intesti-
nales
après
traitement
par
oxygène
hyperbare [69–71] et
également
par
métronidazole [66].
Mais,
à
l’encontre
de
cette
théorie,
on
retient
la
stérilité
des
cultures,
l’absence
de
péritonite
à
la
rup-
ture
des
kystes,
la
négativité
de
la
recherche
de
micro-organismes
en
microscopie
électronique,
l’absence
de
réaction
inflammatoire
majeure
à
l’examen
histologique.
Enfin,
une
association
de
deux
mécanismes
est
possible
dans
certains
cas,
comme
au
cours
des
bronchopneumopathies
chroniques
obstructives,
où
l’hypoxie
chronique
favorise
la
pul-
lulation
de
germes
anaérobies
et
l’hyperpression
prédispose
à
la
diffusion
du
gaz
dans
la
paroi
digestive.
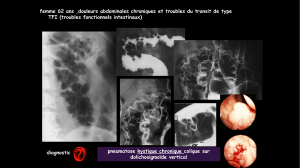
Diagnostic
Circonstances
cliniques
La
pneumatose
kystique
intestinale
est
souvent
asymptoma-
tique,
découverte
fortuitement
en
peropératoire
ou
sur
des
examens
macroscopiques
et
microscopiques
réalisés
pour
un
autre
motif.
Elle
était
autrefois
une
surprise
non
exceptionnelle
de
lapa-
rotomie.
Lorsqu’elle
existe,
la
symptomatologie
est
en
rapport
avec
l’occlusion
luminale,
une
compression
extrinsèque,
ou
une
souf-
france
muqueuse
favorisée
par
les
kystes.
Il
est
important
d’un
point
de
vue
clinique
de
séparer
les
atteintes
de
l’intestin
grêle
et
du
côlon.
La
pneumatose
de
l’intestin
grêle
se
manifeste
par
des
symptômes
digestifs
hauts
(vomissements,
douleurs
abdominales)
ou
par
un
tableau
peu
différent
de
celui
des
entérocolites
nécrosantes.
La
pneumatose
colique
est
plus
volontiers
révélée
par
une
symptomatologie
diges-
tive
basse
(diarrhée,
rectorragies,
glaires
dans
les
selles)
ou
par
un
tableau
de
constipation [72],
d’occlusion,
d’intussusception [73] ou
de
volvulus
colique.
Habituellement
d’évolution
bénigne,
il
existe
des
formes
ful-
minantes
responsables
d’une
évolution
clinique
gravissime,
voire
létale.
En
effet,
la
pneumatose
kystique
intestinale
peut
être
associée
à
un
sepsis
à
anaérobie,
notamment
chez
des
patients
immunodéprimés [74].
Elle
peut
également
être
responsable
de
douleurs
thoraciques
et
de
toux
par
atélectasie
pulmonaire
et
refoulement
intrathoracique
des
viscères
abdominaux
provoqué
par
les
volumineux
kystes.
Examens
paracliniques
L’absence
de
spécificité
des
signes
cliniques
de
la
pneumatose
kystique
intestinale
rend
l’imagerie
d’un
intérêt
majeur
pour
le
diagnostic
positif,
de
nature
(primitive
ou
secondaire)
et
pour
l’apport
d’éléments
pronostiques.
4EMC
-
Gastro-entérologie
© 2019 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 15/06/2019 par UNIVERSITE VICTOR SEGALEN BORDEAUX (14200). Il est interdit et illégal de diffuser ce document.

Pneumatose
kystique
intestinale 9-061-A-30
Figure
4.
Abdomen
sans
préparation
:
bulles
gazeuses
en
«
grappe
de
raisin
».
Figure
5.
Aspect
de
double
contour
gazeux
au
lavement
baryté
en
double
contraste.
Radiologie
Cliché
d’abdomen
sans
préparation
Il
montre
souvent
un
pneumopéritoine.
La
pneumatose
kys-
tique
est
la
première
cause
de
pneumopéritoine
sans
perforation
digestive.
Celui-ci
est
présent
dans
15
%
des
atteintes
de
l’intestin
grêle
et
dans
2
%
des
atteintes
coliques.
Les
kystes
se
traduisent
classiquement
par
des
images
arrondies
hyperclaires
adjacentes
à
la
lumière
digestive
regroupées
en
«
grappes
de
raisin
»
(Fig.
4)
ou
mieux
en
«
chaînette
»,
réalisant
un
aspect
de
double
contour
gazeux.
Un
rétropneumopéritoine
est
possible [75].
Lavement
baryté
Examen
en
voie
de
disparition,
il
montrait
des
images
lacu-
naires,
circulaires,
parfois
confluentes
avec
des
bords
festonnés
(Fig.
5).
Figure
6.
Tomodensitométrie
abdominale
:
bulles
sous-séreuses.
Figure
7.
Tomodensitométrie
abdominale
:
bulles
sous-muqueuses
coliques
en
«
grappe
de
raisin
».
Échographie
abdominale
transpariétale
Elle
suspecte
habituellement
le
diagnostic
en
montrant
un
épaississement
de
la
paroi
intestinale
contenant
de
petites
images
hyperéchogènes
très
réfléchissantes
avec
cône
d’ombre
acous-
tique
traduisant
la
présence
de
bulles
de
gaz
de
taille
réduite
dans
la
paroi
digestive.
En
effet,
la
visualisation
de
bulles
échogènes
autour
de
la
circonférence
de
la
lumière
digestive,
elle-même
écho-
gène,
réalise
le
signe
du
«cercle
»[76].
Un
autre
signe
évocateur
est
le
signe
de
«l’aurore
»qui
correspond
à
des
images
échogènes
linéaires
longues
ou
courtes
dans
la
paroi
antérieure
du
côlon [77].
Tomodensitométrie
abdominale
Le
scanner
qui
révèle
des
images
aériques
intrapariétales
(Fig.
6
à
8)
est
l’examen
essentiel
qui
possède
la
plus
grande
sensibilité
pour
établir
le
diagnostic [37,
78,
79].
Il
permet
de
pré-
ciser
l’étendue
de
la
maladie
ainsi
que
son
caractère
primitif
ou
secondaire
à
d’autres
pathologies
sous-jacentes.
La
pneuma-
tose
intestinale
peut
être
constituée
de
multiples
bulles
(forme
kystique)
ou
avoir
un
aspect
curviligne
(forme
linéaire).
Elle
peut
aussi
revêtir,
dans
certains
cas,
les
deux
aspects
de
manière
concomitante.
De
plus,
la
TDM
est
la
technique
d’imagerie
la
plus
sensible
pour
détecter
d’éventuels
signes
associés
tels
que
la
présence
de
gaz
dans
le
système
porte,
appelée
aéroportie
ou
pneumatose
portale.
Celle-ci
pourrait
être
due
à
une
atteinte
isché-
mique
associée,
avec
dans
ce
cas
un
moins
bon
pronostic [79].
Enfin,
elle
permet
aussi
de
détecter
d’éventuelles
complications
EMC
-
Gastro-entérologie 5
© 2019 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 15/06/2019 par UNIVERSITE VICTOR SEGALEN BORDEAUX (14200). Il est interdit et illégal de diffuser ce document.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%