UE8 – De l’agent infectieux à l’hôte -Dr Thibault
Date : 14/02/18 Plage horaire : 10h45-12h45
Promo : P2 2017/2018 Enseignant : Dr Thibault
Ronéistes : Akhoun Nahema
Vasseur Noémie
Les Antibiotiques : Structure, mode d’action, mécanisme de résistance,
Bactéries Multi-Résistantes et infections nosocomiales
I. Définition
II. Invention des ATB
III. Paramètres d’activité des antibiotiques
1. Spectre d’activité
2. Concentration minimale inhibitrice (CMI)
3. Concentration minimale bactéricide (CMB)
4. Limites des antibiogrammes
IV. Liste des antibiotiques
V. Mode d’action des antibiotiques
1. Inhibition de la synthèse du peptidoglycane
2. Action sur les membranes
3. Action sur la synthèse protéique
4. Action sur l’ADN
5. Action sur la synthèse de l’ARN
6. Action sur les métabolites intermédiaires
VI. Mécanisme de résistance
1. Enzymatique
2. Modification de la cible
3. Imperméabilité
4. Efflux
1

VII. Vers la multi-résistance et au-delà
VIII. Pénurie de nouvelles molécules
IX. Conséquences
X. Conclusion
Ceci n’est qu’une introduction aux antibiotiques (ATB).
Les ATB sont un vrai souci de Santé Publique aussi bien en France que dans le monde entier. L’objectif du cours n’est
pas de connaitre la liste des ATB par coeur (ça sera pour plus tard :/), mais d’avoir une première approche de ce qui a
été fait, de la situation délicate actuelle et de ce qui est encore faisable au sujet des ATB. Il est important de s’informer
dans le temps.
I. Définition
Du grec anti : « contre », et bios : « la vie »
Un antibiotique est une molécule chimique, d’origine naturelle (pour la majeure partie: plantes, bactéries,
champignons,..) ou synthétique, qui détruit ou bloque la croissance des bactéries et possède une toxicité
sélective contre la bactérie et non contre l’hôte. Ils s’opposent aux antiseptiques.
Un antiseptique c’est un tue tout. Antiseptique : utilisation locale uniquement. Il a pour fonction de tuer un
maximum de germes de manière non sélective.
Un ATB est une molécule spécifique contre un germe donné. Il a pour objectif de tuer uniquement ce dernier
et si possible de n’avoir aucun effet négatif sur la personne qui en prend.
Un antibiotique ne doit pas être toxique pour l’homme, ça s’ingère et ça s’injecte. Il doit avoir une
activité complètement sélective contre les bactéries. Mais ce n’est pas complètement vrai, on a quand
même des gros bazookas à l’heure actuelle, c’est-à-dire qu’on tue les mauvaises bactéries mais on n’est pas
aussi sélectif qu’on le voudrait, sinon on n’aurait pas d’effets secondaires suite aux ATB. Certes si on est
efficace on réussira à tuer les germes mais on va aussi tuer aussi toutes les bactéries qui sont sensibles à cet
ATB dans notre tube digestif, et à un moment donné cela va modifier notre flore et on va garder dans notre
flore commensale que des bactéries résistantes.
La plupart des molécules sont parfaitement naturelles, elles sont fabriquées en général par des champignons
ou des bactéries (pour se protéger contre les autres bactéries, pour se propager) => Principal moyen de
découverte d'antibiotiques. Elles peuvent également être synthétiques.
Ils agissent via le blocage d’une étape essentielle du développement des bactéries, de façon à tuer ou à
inhiber la croissance de la bactérie.
2

Cela peut agir sur: la synthèse de la paroi, les peptidoglycanes de la membrane, la synthèse de l’ADN, la
synthèse de l’ARN, la traduction, la production d’énergie, de métabolites …
L’ATB agit sur un moment clé du fonctionnement de la bactérie pour la tuer ou du moins arrêter sa
croissance et laisser le reste au système immunitaire.
II. Invention des ATB
Depuis l’Antiquité, on a pu recourir empiriquement à des moisissures se développant sur le pain, le soja…
On a trouvé des traces de tétracycline retrouvées sur les restes du peuple nubien 2000 ans avant JC. On
n’est pas sûr qu’ils utilisaient les tétracyclines à visée antibiotique, puisqu’ ils faisaient de la bière et que le
grain utilisé dans la préparation de la bière contient des bactéries appelées streptomycines, productrices de
cet antibiotique. Cet exemple n’est pas le seul, on a trouvé des traces d’antibiotiques chez les Egyptiens et
d’autres populations antiques…
Plus récemment, à partir des années 1850, on a longtemps tâtonné, et on a commencé à se rendre compte
qu’on pouvait guérir le mal par le mal, en introduisant une bactérie chez une personne infectée, la bactérie
introduite guérissant la première infection: c’est la compétition bactérienne.
En 1877, Pasteur a trouvé qu’en injectant à des rats de l’anthrax et diverses bactéries du sol, ils ne faisaient
pas la maladie du charbon.
En 1885, on a réussi à traiter une tuberculose en pulvérisant du Bacterium termo. (Arnaldo Cantani)
En 1887, en injectant de streptocoques à des animaux, qui protègent du choléra. (Rudolf Emmerich)
En 1928 : la pénicilline découverte par Fleming, active contre les staphylocoques dorés. Cependant il a
fallu une vingtaine d’année pour l’utiliser.
En 1932, Prontosil®, un sulfamide, premier antibiotique de synthèse à être passé sur le marché.
En 1939, tyrothricine : 1er antibiotique commercialisé en application locale.
Utilisation locale des ATB surtout pendant la 2nde Guerre Mondiale pour guérir les blessures et les ulcères
(éviter la gangrène), et expansion totale des ATB après la guerre (de synthèse ou naturelle).
– 1944, streptomycine
– 1952, érythromycine
– 1956, vancomycine
– 1962, quinolones
– 1980, fluoroquinolones
– 2000, le Linezolide®
Au début on a découvert une multitude d’antibiotiques mais depuis la découverte est ralentie, on améliore
plutôt des molécules déjà existantes.
Ce qu’il faut retenir c’est qu’au siècle dernier avec l’invention et la commercialisation des différents
antibiotiques, on a gagné en moyenne pour l’être humain 15 ans d’espérance de vie supplémentaire.
3

Par comparaison, si aujourd’hui on inventait le traitement miracle qui guérirait absolument tous les
cancers qui existent, on ne gagnerait qu’entre 1 – 1,5ans d’espérance de vie sur la moyenne, ce n’est rien
par rapport à ce qu’on a gagné avec les ATB. Pareil pour les maladies cardiovasculaires, on ne gagnerait
que 6 mois d’espérance de vie. Parce que les maladies infectieuses touchent la plupart du temps toutes les
populations contrairement au cancer où la moyenne d’âge est élevée.
III. Paramètres d'activité des ATB
Quand on parle d’antibiotiques il y a 3 notions qu’il faut connaître :
- Le spectre d’activité de l’antibiotique
- La concentration minimale inhibitrice : CMI
- La concentration minimale bactéricide : CMB
1. Spectre d’activité :
Un spectre d’activité, c’est la liste des espèces bactériennes sur lesquelles un ATB agit. C’est propre à
chaque antibiotique. Il faut savoir que chacun de ces germes peuvent muter ou se conférer des mécanismes
de résistance, et donc peuvent sortir du spectre d’activité de l’ATB. Cette notion est évolutive dans le temps
(réévaluée tous les ans par le comité d’antibiothérapie).
2. Concentration minimale inhibitrice (CMI) :
Définition arbitraire, donnée in vitro: c’est la concentration minimale d’un antibiotique qu’il faut pour
inhiber totalement la croissance de 106 bactéries/mL (un inoculum) qu’on inocule à 37°c pendant 18H.
3. Concentration minimale bactéricide (CMB) :
C’est un peu la même chose que la CMI sauf qu’au lieu d’inhiber la croissance, c’est la concentration
minimale pour tuer 99,9 % de votre inoculum initial qui était de 106 bactéries/mL inoculées pendant 18H
à 37°.
La CMI et la CMB sont caractéristiques d’un antibiotique pour une bactérie donnée. Ce sont
complètement des données de laboratoires. Ex l’Augmentin va jouer sur 60 espèces de bactéries
différentes, sur la bactérie A il va avoir une CMI et CMB de tant, alors que pour la bactérie B il va avoir une
CMI et CMB différente.
•Quand on a un rapport CMB/CMI qui est proche de 1 : la concentration minimale pour tuer les
bactéries est très proche de la concentration minimale pour inhiber leur croissance, on dit que
l’antibiotique est bactéricide. Il va rapidement tuer la bactérie. Ce sont ceux qu’on essaye de
privilégier en pratique clinique car l’objectif premier est de tuer les bactéries.
4

•Si vous avez un rapport CMB/CMI qui est supérieur à 2 : cela veut dire qu’il faut une
concentration beaucoup plus importante pour les tuer. Vous allez inhiber rapidement leur croissance
mais vous n’allez pas les tuer. A ce moment-là on dit que l’antibiotique est bactériostatique. On les
utilise en deuxième intention, en sachant que c’est le système immunitaire qui va prendre le relais.
Ce sont des antibiotiques qui permettent de limiter la prolifération des germes, ils représentent la
majorité des ATB aujourd’hui.
À partir du moment où vous êtes devant un patient qui est immunodéprimé ou quand vous avez un patient
qui est très vieux ou un bébé très jeune et qu’il est en état de choc septique, on va privilégier un antibiotique
qui sera bactéricide.
Plus le problème de santé est grave, plus on aimera utiliser un ATB qui est
bactéricide, mais parfois on n’a pas le choix et on utilise les bactériostatiques et
on fait confiance au système immunitaire pour terminer le travail.
Dans la pratique pour savoir la CMI, on met un inoculum de !bactéries par
ml à 37°c en couche monocellulaire et on rajoute des pastilles d’antibiotique.
On attend 18H et on regarde les ronds d’inhibition autour des pastilles, lorsque
les bactéries ont reculé au contact des antibiotiques. Le diamètre d’inhibition
nous permet de calculer la CMI par un calcul mathématique.
Maintenant c’est fait grâce à des automates.
Dans la pratique clinique, lors d’une infection on va faire un prélèvement (urinaire, sanguin…) qui va être
mis en culture au laboratoire. Le laboratoire donnera la bactérie présente dans l’échantillon et un
antibiogramme qui nous donnera sa sensibilité à différents types d’antibiotiques pour nous aider à prescrire
dans la pratique courante.
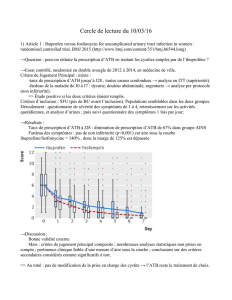
Lecture d’un antibiogramme pour in-vivo:
!
106
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%