Chimio-prévention du cancer du sein É “Seules les évidences peuvent stupéfier”

“Seules les évidences peuvent stupéfier”
Roland Barthes
es premiers résultats du 4eessai de chimioprévention
du cancer du sein par le tamoxifène viennent d’être
présentés lors de la 3eConférence sur le cancer du
sein – EBCC3 – à Barcelone, par l’investigateur principal
J. Cuzick (1). Les résultats et les commentaires des auteurs
sont rapportés dans la rubrique Congrès de ce numéro (p. 29).
Si les résultats eux-mêmes ne sont pas à mon avis surprenants,
les commentaires le sont davantage ; il convient de rapprocher
ces données de celles des quatre autres études déjà publiées
avec le tamoxifène (2-4) et le raloxifène – essai MORE (5).
LE TAMOXIFÈNE EST EFFICACE
C’est la conclusion logique des résultats présentés par Cuzick :
7139 femmes ont donc été randomisées dans cet essai pros-
pectif comparant le tamoxifène – à la dose de 20 mg/jour pen-
dant 5 ans – à un placebo. Elles ont été sélectionnées sur la
notion d’un risque individuel élevé, lié à des antécédents fami-
liaux, notamment l’apparition d’un cancer du sein avant 50 ans
chez la mère ou une sœur, ou chez deux parents au 2edegré.
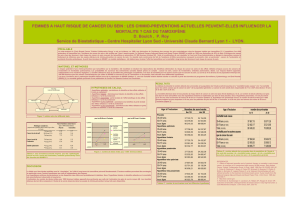
Les caractéristiques de la population sont décrites dans le
tableau I : ces femmes sont relativement jeunes, la moitié
d’entre elles seulement est ménopausée, un tiers a subi une
hystérectomie et, élément important, 40 % environ reçoivent
un traitement hormonal substitutif (THS).
Les résultats décrits dans le tableau II sont proches de ceux
attendus à la lumière, d’une part, de la réduction du risque
observée chez les femmes traitées en situation adjuvante pour
cancer du sein et, d’autre part, de l’essai NSABP P01 et de
l’essai MORE. Il existe une réduction d’incidence de 33 %,
uniquement des cancers contenant des récepteurs hormonaux.
Le bénéfice concerne à la fois les cancers invasifs et les can-
cers in situ, quel que soit l’âge. Ce bénéfice semble moindre
chez celles qui reçoivent un THS.
Une analyse globale des 4 essais utilisant le tamoxifène a été
effectuée : si l’essai du NSABP démontre une réduction signi-
ficative (odd ratio = 0,5), l’analyse des 4 essais groupés
retrouve une réduction non significative de 38 %, d’après les
chiffres présentés par J. Cuzick.
La conclusion que “l’effet préventif du tamoxifène n’est pas
clairement démontré” me paraît inexacte. Trois des essais de
chimioprévention sont positifs : ce sont l’essai NSABP P01,
l’essai MORE utilisant le raloxifène et l’essai IBIS I. Même si
l’interprétation de ce dernier ne pourra être achevée qu’après
sa publication complète, il faut cependant souligner les faits
suivants :
– il a inclus presque deux fois moins de malades que l’essai du
NSABP ;
– la compliance du traitement est médiocre dans le bras
tamoxifène (67 %) mais également placebo (77 %). Cela peut
expliquer le fait que le bénéfice ne soit “que” de 33 %, alors
qu’il est d’environ 50 %, voire plus dans les essais NSABP P01
ou MORE. La compliance médiocre était également observée
dans l’essai italien dans lequel on observe pourtant une réduction
de l’incidence chez les femmes ayant reçu le tamoxifène (4) ;
ÉDITORIAL
3
La Lettre du Sénologue - n° 16 - avril/mai/juin 2002
Chimio-prévention du cancer du sein
résultats de l’essai IBIS I : une autre lecture
● P. Kerbrat*
* Département d’oncologie médicale, Centre Eugène-Marquis, Rennes.
L
Placebo Tamoxifène
Population totale = 7 139 3 566 3 573
Recul moyen (mois) 50 50
Compliance (%) 77 67
Âge moyen (ans) 51 51
Postménopause (%) 49 49
Hystérectomie (%) 34 34
THS (%) 40 40
Tableau I. Essai IBIS I. Caractéristiques de la population.
Nombre de cancers Placebo Tamoxifène
Total 101 68 (S)
•in situ 16 5 (S)
•invasif 85 63 (NS)
Avant 50 ans 39 25
Après 50 ans 62 43
Cancers invasifs RE + 60 43 (S)
RE – 25 20 (NS)
Tableau II. Essai IBIS I. Résultats.

ÉDITORIAL
– l’essai IBIS I est, comme l’essai du Royal Marsden, “pollué”
par l’utilisation d’un THS. Le taux d’utilisation était à peu près
identique dans celui-ci (42 %) ; il faut rappeler, de plus, que
cette dernière étude a inclus le plus petit nombre de malades
(3).
Plusieurs critiques avaient été formulées vis-à-vis de l’essai
NSABP P01. Fisher avait lui-même brillamment répondu à bon
nombre d’entre elles (6). Des travaux plus récents sont venus en
effacer d’autres. La première critique d’ordre méthodologique
concernait l’absence de bénéfice sur la survie ; elle est à nou-
veau exprimée par Cuzick. Cependant, il faut rappeler que le but
des essais de prévention est, non la réduction de mortalité, mais
la réduction d’incidence comme l’avait souligné Lippman (7).
Cette réduction est observée dans les trois essais les plus larges.
Une deuxième critique concernait la méthode de sélection,
notamment dans l’essai NSABP P01. Cette méthode, selon le
calcul de Gail, a été appliquée à une cohorte de plus de 82 000
femmes d’origine caucasienne. Le nombre de cancers observés
est très proche de celui attendu, avec un ratio E/O de 0,94 (8).
D’autres critiques concernaient l’absence de bénéfice connu
chez les femmes à risque “génétique”, c’est-à-dire sélection-
nées sur des critères d’antécédents familiaux, par rapport à
celles à risque “hormonal”, sélectionnées sur l’âge et les carac-
téristiques de la vie génitale. En fait, l’étude de Narod a
confirmé le bénéfice de l’hormonothérapie chez les femmes
présentant une mutation de BRCA1, avec une réduction du
cancer controlatéral sous tamoxifène d’environ 50 %, et même
75 % si le tamoxifène est poursuivi pendant 2 à 4 ans (9). Ce
bénéfice est également observé dans cette catégorie de femmes
dans l’essai NSABP P01 (10). Cela est d’ailleurs également
vrai pour la castration (11).
La question avait également été posée du réel effet préventif
de l’hormonothérapie, c’est-à-dire empêchant l’apparition de
cancer du sein, ou d’un effet “traitement précoce”, c’est-à-dire
retardant son apparition clinique. Il est en fait probable que les
deux phénomènes coexistent :
– dans l’essai du NSABP, les courbes divergent très tôt, cor-
respondant vraisemblablement à l’effet “traitement précoce”
(2) ;
– cependant, elles continuent à diverger même après l’arrêt du
traitement, pouvant laisser espérer un effet préventif réel. Cela
a été confirmé par l’étude de Tanchiu, présentée à San Antonio
en décembre 2001 : chez les femmes incluses dans l’essai P01
du NSABP, il observe une réduction significative des maladies
“bénignes”, dont certaines prédisposent au cancer du sein,
comme cela est indiqué dans le tableau III (12).
Il persiste cependant des inconnues, notamment la durée opti-
male du traitement et la définition d’une population tirant un
bénéfice maximal de celui-ci.
Pour moi, l’essai IBIS I ne fait que confirmer ce bénéfice, per-
mettant de conclure avec K. Pritchard, à la suite de l’essai
NSABP P01 : “le tamoxifène donné pendant 5 ans à cette
population induit une réduction d’environ 50 % de l’incidence
du cancer du sein avec au moins un recul de 5 à 6 ans” (13).
LE TAMOXIFÈNE EST TOXIQUE
Là aussi, les résultats de l’essai IBIS I étaient attendus : ils sont
conformes aux prévisions. Le tamoxifène multiplie par 3 envi-
ron le risque de cancer de l’endomètre, par 2,5 environ les
risques de thrombophlébite, et il majore les bouffées de cha-
leur (1). Cela est également observé dans la revue des 3 essais
de prévention utilisant le tamoxifène et ne constitue pas une
nouveauté : l’augmentation de l’incidence des cancers de
l’endomètre a conduit le CIRC à faire figurer cette molécule
sur la liste des produits “cancérigènes”, avec le battage média-
tique dont on se souvient. Il faut quand même en rappeler
l’importance : l’incidence spontanée des cancers de l’endo-
mètre est d’environ 1/1 000, et elle passe à 3/1 000 en cas de
prise de tamoxifène. Ces tumeurs sont en général limitées et de
bas grade, donc de bon pronostic (2). La toxicité thrombo-
embolique est du même ordre de grandeur. Quant aux acci-
dents létaux, ils sont, pour les embolies, les accidents vascu-
laires cérébraux ou les accidents cardiaques, de l’ordre de
quelques unités, alors que 7 139 femmes ont été incluses : on
ne sait pas s’il existait des facteurs vasculaires favorisants.
Ces résultats sont donc très voisins de ceux qui ont été obser-
vés dans l’essai NSABP P01, où la toxicité était limitée aux
femmes ménopausées (2).
Il faut également souligner que, si le tamoxifène induit des effets
secondaires néfastes, il a aussi des effets favorables. Ceux-ci
avaient été très bien analysés par Ragaz qui a montré que, chez
les femmes traitées pour cancer du sein, en excluant le bénéfice
sur le cancer lui-même, on observait une réduction de la morta-
lité du fait des effets secondaires favorables, malgré les effets
délétères (14). Il faut rappeler également que la qualité de vie
semble acceptable, notamment sans retentissement psycho-
logique (15) ni sexuel (16).
L’AVENIR
Quelles conclusions temporaires peut-on tirer de ces essais ? La
chimioprévention hormonale du cancer du sein est efficace.
Trois essais terminés le prouvent, amenant à mon sens un
niveau d’évidence 1. Cela a conduit à la mise sur le marché aux
États-Unis de cette molécule, dans cette indication, c’est-à-dire
chez les femmes présentant des facteurs de risque définis selon
le modèle de Gail. Le tamoxifène est efficace en situation méta-
statique, adjuvante, après cancers in situ, en prévention.
Pourquoi n’est-il pas utilisé en France, pourquoi suscite-t-il
autant de critiques ? Il peut paraître tout à fait légitime de ne pas
vouloir prescrire un médicament “cancérigène”, ou induisant
4
La Lettre du Sénologue - n° 16 - avril/mai/juin 2002
Réduction d’incidence (%)
Adénome 41
Maladie fibrokystique 33
Kystes 32
Hyperplasie 38
Métaplasie 48
Nombre total de biopsies 22
Tableau III. Prévention par le tamoxifène. Réduction des lésions
bénignes dans la population du NSABP P01.

des effets secondaires néfastes, chez des femmes saines. Cela
n’empêche pas la prescription, dans une population voisine, de
contraceptifs oraux qui ne sont pas dénués d’effets secondaires.
Cette prudence est toutefois partagée par les femmes elles-
mêmes : en effet, il faut rappeler que, dans l’essai du NSABP,
90 000 femmes environ avaient été contactées et qu’un peu plus
de 13 000 seulement ont participé à l’étude. De plus, la com-
pliance était très imparfaite, évaluée à 67 % dans l’essai IBIS I.
Elle était également très mauvaise dans l’essai italien, récemment
actualisé, où, sur 2 700 femmes devant recevoir du tamoxifène,
979 sont sorties d’étude, dont 674 ont arrêté le traitement volon-
tairement, pour 1 217 ayant atteint les 5 ans initialement prévus
(17). Cependant, pourquoi ne propose-t-on pas à ces femmes “à
risque”, parfois à risque très élevé notamment pour des raisons
familiales, ce type de traitement en les informant des risques
potentiels, comme pour tout traitement ?
L’existence des effets secondaires justifie donc le maintien
dans l’essai suivant, IBIS II, d’un groupe témoin recevant un
placebo, et qui sera comparé à un groupe recevant 5 ans de
tamoxifène et à un autre recevant 5 ans d’anastrozole. L’utili-
sation de cette molécule est évidemment soutenue par les
résultats de l’essai ATAC, publié à San Antonio en décembre
2001, montrant en situation adjuvante un bénéfice de l’anastro-
zole par rapport au tamoxifène (18). De plus, cette molécule ne
semble pas induire de cancer de l’endomètre ou d’accident
thrombo-embolique. Cependant, sa tolérance osseuse à long
terme est mal connue pour l’instant.
Il semble donc bien que l’efficacité de la chimioprévention hor-
monale ne puisse être mise en doute mais que le défi actuel soit
de réduire autant que possible sa toxicité, avant d’étudier son
association éventuelle avec d’autres molécules (19, 20).
Une dernière interrogation enfin : en combien de temps serait
commercialisée une molécule abaissant de 30 à 40 % l’inci-
dence du cancer bronchique ? ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Cuzick J. Up-date of new studies in Europe. 3rd European Breast Cancer
Conference, 19-23 March 2002. Eur J Cancer 2002 ; 38 (suppl. 3) : S44.
2. Fisher B, Costantino JP, Wickerham DL et al. Tamoxifen for prevention of
breast cancer : report of the National Surgical Adjuvant Breast and Bowel pro-
ject P-1 Study. J Natl Cancer Inst 1998 ; 90 (18) : 1371-88.
3. Powles T, Eeles R, Ashley S et al. Interim analysis of the incidence of breast
cancer in the Royal Marsden Hospital tamoxifen randomised chemoprevention
trial. Lancet 1998 ; 352 : 98-101.
4. Veronesi U, Maisonneuve P, Costa A et al. Prevention of breast cancer with
tamoxifen : preliminary findings from the Italian randomized trial among hyste-
rectomised women. Italian Tamoxifen Prevention Study. Lancet 1998 ; 352 : 93-7.
5. Cauley JA, Norton L, Lippman ME et al. Continued breast cancer risk reduc-
tion in post menopausal women treated w134.th raloxifen : 4 years results of
MORE trial. Breast Cancer Res Treat 2001 ; 65 (2) : 125-34.
6. Fisher B. National Surgical Adjuvant Breast and Bowel Project : breast cancer
prevention trial : a reflective commentary. J Clin Oncol 1999 ; 17 (5) : 1632-9.
7. Brown PH, Lippman SM. Chemoprevention of breast cancer. Breast Cancer
Res Treat 2000 ; 62 : 1-17.
8. Gail MH, Costantino JP. Validating and improving models for projecting the
absolute risk of breast cancer. J Natl Cancer Inst 2001 ; 93 (5 ): 334-5.
9. Narod SA, Brunet JS, Ghadirian P et al. Tamoxifen and risk of contralateral
breast cancer in BRCA1 and BRCA2 mutation carriers : a case-control study.
Lancet 2000 ; 356 : 1876-81.
10. King MC, Wiend S, Hale K et al. Tamoxifen and breast cancer incidence
among women with inherited mutations in BRCA1 and BRCA2. National Surgi-
cal Adjuvant Breast and Bowel project (NSABP-P1). Breast cancer prevention
trial. JAMA 2001 ; 286 (18) : 2251-6.
11. Eisen A, Rebbeck TR, Wood WC, Weber BL. Prophylactic surgery in
women with a hereditary predisposition to breast and ovarian cancer. J Clin
Oncol 2000 ; 18 (9) : 1980-95.
12. Tanchiu E, Costantino J, Wang J et al. The effects of tamoxifen on benign
breast disease. Findings from the National Surgical Adjuvant Breast and Bowel
Project (NSABP). Breast cancer prevention trial. Breast Cancer Res Treat
2001 ; 69 (3) : 210 (abstr. 7).
13. Fisher B, Powles TJ, Pritchard KJ. tamoxifen for the prevention of breast
cancer. Eur J Cancer 2000 ; 36 : 142-50.
14. Ragaz J, Coldman A. Survival impact of adjuvant Tamoxifen on competing
causes of mortality in breast cancer survivors, with analysis of mortality from
contralateral breast cancer, cardiovascular events, endometrial cancer, and
thromboembolic episodes. J Clin Oncol 1998 ; 16 (6) : 2018-24.
15. Day R, Ganz PA, Costantino JP. Tamoxifen and depression : more evidence
from the National Surgical Adjuvant Breast and Bowel project’s breast cancer
prevention (P-1) randomized study. J Natl Cancer Inst 2001 ; 93 (21) : 1615-23.
16. Fallowfield L, Fleissig A, Edwards R, et al. Tamoxifen for the prevention of
breast cancer : psychosocial impact on women participating in two randomized
controlled trials. J Clin Oncol 2001 ; 19 (7) : 1885-92.
17. Veronesi U, Maisonneuve P, Sacchini V et al. Tamoxifen for breast cancer
among hysterectomised women. Lancet 2002 ; 359 : 1122-4.
18. Baum M on behalf of the ATAC Trialists’Group. The ATAC (Arimidex,
Tamoxifen, Alone or in Combination) adjuvant breast cancer trial in post meno-
pausal women. Breast Cancer Res Treat ; 2001 ; 69 (3) : 210 (abstr. 8).
19. Sporn MB. Hobson’s choice and the need for combinations of new agents for the
prevention and treatment of breast cancer. J Natl Cancer Inst 2002 ; 94 (4) : 242-4.
20. Jordan VC, Morrow M. Chemoprevention of breast cancer : a model for
change. J Clin Oncol 2002 ; 20 (1) : 1-3.
5
La Lettre du Sénologue - n° 16 - avril/mai/juin 2002
À tous nos lecteurs, à tous nos abonnés
La Lettre du Sénologue
vous souhaite un bel été et vous remercie
de la fidélité de votre engagement
Belles lectures ensoleillées
Le prochain numéro paraîtra en septembre
1
/
3
100%