TUMEURS DE L`ESTOMAC

Lundi 02/04/07 13h30>15h30 Dr Cabasset
UF : affections digestives
Les pathologies en digestif
-1/8-
TUMEURS DE L’ESTOMAC
I/ INTRODUCTION :
Le cancer de l’estomac est le 4° cancer en fréquence derrière le cancer colorectal, celui du
sein, du poumon et celui de la prostate. C’est le deuxième cancer digestif derrière le cancer
colorectal. Son incidence annuelle en France est de 11,1/100 000 chez l’homme, 4/100 000
chez la femme (100/100 000 au Japon). On dénombrait, en 2000, 7000 nouveaux cas.
On assiste actuellement à une baisse de l’incidence grâce probablement à l’amélioration de
l’alimentation.
Il est 2 à 3 fois plus fréquente chez l’homme que chez la femme. L’age moyen de survenue est
de 70 ans.
Malgré les progrès diagnostiques et thérapeutiques, son pronostic reste mauvais. Le taux de
survie à 5 ans est de 10 à 15%.
Le cancer de l’estomac se développe sur une gastrite. Les facteurs de risque sont multiples. Il
existe des formes familiales indiscutables dues à la mutation d’un anti-oncogène. Dans ce cas,
on effectue une gastrectomie prophylactique à l’age de 20 ans. On doit suspecter une telle
prédisposition devant la survenue d’un cancer gastrique avant l’age de 40 ans et déclencher
une enquête oncogénétique familiale.
Un régime riche en fibres, en légumes crus et en fruits contenant de la vitamine C est
protecteur. A l’opposé, un régime hypersalé est un facteur de risque. La conservation sous
forme de salaisons serait néfaste(nitrites, nitrates, nitro-amines). L’exposition aux
hydrocarbures, le reflux biliaire sont également des facteurs de risque.
Le risque de cancer de l’estomac est 3 à 6 fois plus élevé chez les sujets atteints d’une
infection à Helicobacter pylori que chez les sujets non infectés.
Une gastrectomie partielle pour ulcère est un facteur de risque de développer un cancer (sur le
moignon).
D’autres conditions précancéreuses sont rares comme les polypes gastriques, la maladie de
Biermer, la maladie de Ménétrier.
Dans le schéma de la carcinogenèse, une gastrite atrophique (due à une forte consommation
de sel et/ou une mauvaise nutrition et/ou une infection à Helicobacter pylori) se transforme en
métaplasie intestinale puis en dysplasie (légère, modérée puis sévère) puis en cancer.

-2/8-
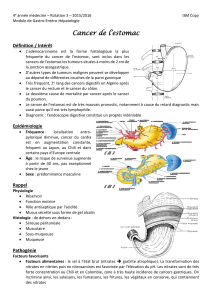
II/ ANATOMO-PATHOLOGIE :
Macroscopiquement, on différencie des cancers polypoide, creusant, ulcéré, plat, surélevé,
infiltrat…
Classification de Paris (2003)

-3/8-
L’adénocarcinome gastrique représente 90% des cas. On peut différencier plusieurs sous
types comme l’adénocarcinome papillaire (bien différencié), le tubuleux (bien, peu ou
indifférencié), le mucineux à cellules indépendantes, le carcinome adénosquameux, le
carcinome épidermoïde, le carcinome à petites cellules, le carcinome indifférencié.
Le cancer superficiel de l’estomac représente 10% des cas et est caractérisé par une évolution
très lente et un excellent pronostic (survie de 80% à 5 ans).
La linite plastique est un adénocarcinome peu ou pas différencié envahissant la paroi
gastrique jusqu’à la séreuse souvent associée à un envahissement ganglionnaire et à une
carcinose péritonéale (survie à 5 ans environ 10%). L’association à des métastases ovariennes
réalise le syndrome de Krukenberg.
Les autres types histologiques regroupent les tumeurs neuro-endocrines, les tumeurs stromales
(GIST), les métastases gastriques (cancer du sein, des bronches, de mélanome), les
lymphomes gastriques [avec notamment le Mucosa Associated Lymphoïd Tissu (MALT),
lymphome de bas grade pouvant être guéri par l’éradication d’Helicobacter pylori auquel il est
associé], sarcome de Kaposi, leïomyosarcomes, schwannosarcomes, carcinoïdes gastriques.
On décrit également des tumeurs bénignes comme des lipomes, des angiomes, des polypes,
des leïomyomes et autres schwannomes.

-4/8-
III/ DIAGNOSTIC :
A/ Diagnostic positif :
1) Signes fonctionnels :
Ils sont variés :
• Dysphagie ;
• Hémorragies digestives ;
• Altération de l’état général ;
• Dégoût alimentaire notamment pour les viandes ;
• Anémie, fièvre inexpliquée, thrombophlébite (phlébite de Trousseau);
• Métastases hépatiques révélatrices, ascite (par carcinose péritonéale).
• Syndrome paranéoplasique (acanthosis negricans, neuropathie périphérique, kératose
actinique multiple)
2) Signes physiques :
L’examen clinique est le plus souvent normal. Parfois, on palpe une masse du creux
épigastrique, un nodule ombilical, une hépatomégalie, un ganglion de Troisier (creux sus
claviculaire gauche), une masse ovarienne ou un nodule du cul de sac de Douglas.
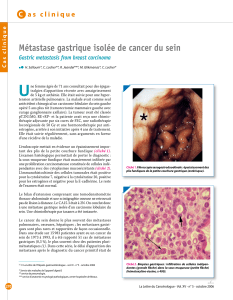
L’endoscopie permet le diagnostic en mettant en évidence une tumeur bourgeonnante, une
tumeur ulcérée ou une tumeur infiltrante. Les biopsies seront multiples et on précisera la
topographie de la lésion.
B/ Bilan préopératoire :
Le diagnostic d’adénocarcinome gastrique posé, on recherchera des métastases (hépatiques,
pulmonaires, osseuses, surrénaliennes, thyroïdiennes, cutanées, ganglionnaires, péritonéales et
ovariennes) et on appréciera l’opérabilité du patient avant d’envisager le traitement
chirurgical. On peut utiliser plusieurs classification (ASA, OMS, Karnofsky).

-5/8-
On demandera :
• Un transit œsogastroduodénal (pour un diagnostic topographique) ;
• Un scanner thoraco-abdo-pelvien ou une IRM en cas de contre-indication;
• Une écho endoscopie (supérieure au scanner pour apprécier l’extension pariétale et
l’existence d’adénopathies métastatiques) ;
• Les marqueurs tumoraux (ACE et le CA 19.9) sont d’intérêt discuté.
Au terme de ce bilan, on classera, grâce à la classification TNM (Tumor, Nodes, Metastasis)
de l’UICC (1997), le patient dans un but thérapeutique et pronostique. Par exemple, un patient
N0 a une survie à 5 ans estimée à 80%, elle tombe à 35% si N1, 10% si N2.
 6
6
 7
7
 8
8
1
/
8
100%